本文是一篇医学论文,本文将所开发的 DNA 捕获技术和信号传感技术联用,完成了对非洲猪瘟和新冠病毒的标准序列的检测,证明了一定的技术可行性,打通了从“捕获”到“传感”的 DNA 检测流程,为相关技术开发提供了一定的借鉴。
第一章 绪论
1.1 DNA 检测技术的相关研究
1.1.1 DNA 检测技术的原理
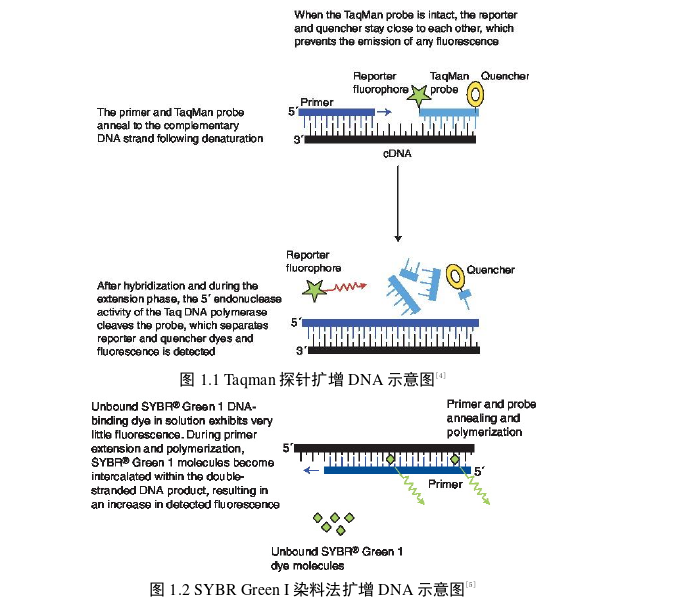
目前,针对核酸的检测技术已经趋于完善,尤其是 DNA 检测中的 PCR 技术。目前在生物科学、诊断学和法医学中使用的最有价值的技术之一。在过去 100 年中,很少有发明可以与 PCR 的重要性相提并论,因为它彻底改变了生物学和遗传研究[1]。我们都知道 PCR 的反应原理是三步法,通过设计上游和下游引物对模板进行扩增[2]。这种方式可以模拟生物体内 DNA 的复制,这种扩增方式需要 4 种核苷酸、酶和引物,在短时间内可以实现 DNA 的快速复制,从而为遗传学和诊断学提供了可靠的基础。另一个金标准的检测方式逐渐开始取代传统 PCR 的技术。荧光定量 PCR(Quantitative Real-time PCR, qPCR)已经开始成为人们主要的检测手段,qPCR 允许对核酸进行灵敏、特异和可重复的检测。自推出以来,已经彻底改变了分子诊断领域,并且该技术正被迅速推广。这项激动人心的技术使分子诊断转向了一种周转时间更短的高通量、自动化技术。qPCR 的原理如图 1.1 所示,荧光定量 PCR 是对 PCR 过程每个循环中产生的产物的可靠检测和测量,这些产物与 PCR 过程开始前的模板量成正比。Holland及其同事证明了热稳定性 DNA 聚合酶具有外切核酸酶活性[3]。此外,标记单链探针的引入用于探针降解分析。虽然探针完好无损,但猝灭剂的紧密连接显著降低了报告染料发出的荧光。基于荧光共振能量转移 (FRET) 原理,仅在切割探针时才会发出荧光信号,另外通过染料结合 DNA 分子中发出荧光。在扩增时,随着 DNA 链的增多,SYBR Green I 的荧光阈值也就随之增高。如图 1.2 所示。
1.2 成簇的规则间隔短回文重复序列( Clustered Regularly Interspaced Short Palindromic Repeats, CRISPR)及其相关核酸酶(Cas)的应用
1.2.1 生物体内 CRISPR/Cas 系统的工作原理
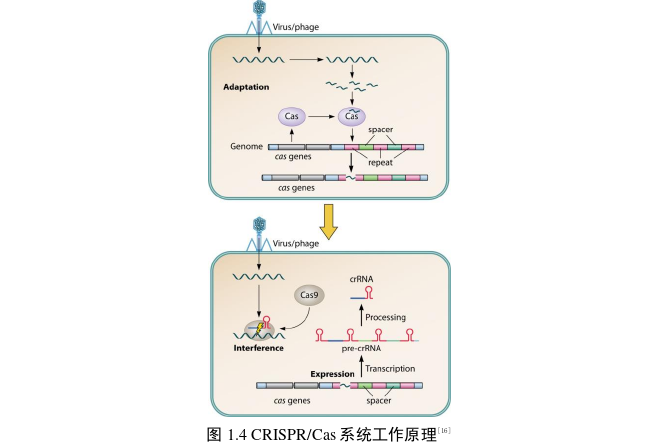
CRISPR/Cas 是一种适应性抗病毒免疫系统,存在于细菌中,通过互相识别发挥作用[13]。这些系统将外来 DNA 片段(称为间隔区)整合到 CRISPR 中,然后转录包含间隔区的 CRISPR 阵列,并对其进行处理以制造用于特异性靶向和切割同源基因组的向导 crRNA(CRISPR RNA)。Cas 蛋白参与 CRISPR 基因转录、目标 DNA 或 RNA 的切割以及新的间隔区整合的不同步骤[14, 15]。具体过程如图 1.4 所示。
第二章 银纳米粒子的修饰和 d Cas9 的重组表达及功能鉴定
2.1 前言
现阶段,表面增强光谱依然是对材料表征和检测的重要手段,而表面增强拉曼相较于传统拉曼检测方式,其优势在于纳米粒子可以通过一定范围内的波长下的电磁增强来提高拉曼光谱的峰值。因此对于探针的稳定与否至关重要,目前该探针分为有标记探针和无标记探针,前者需要在表面修饰一定的结构来获得可以捕获 DNA 的探针。后者则通过除去探针表面杂质或向外包裹一层壳类结构来组成无标记的探针。
本实验中我们首先开发了两种拉曼探针。简而言之,第一种通过在银纳米粒子表面修饰一层碘离子,碘离子会取代纳米粒子表面的柠檬酸钠等杂质,最终结果导致探针表面光滑,并且所带电荷均一。另一种通过结合 CRISPR/dCas9技术,将银纳米粒子表面通过 NHS 和 EDC 修饰一层 dCas9 蛋白,这种蛋白可以和 gRNA 直接结合,形成可以特异性捕获 DNA 的新型探针。此外,我们对 dCas9 进行了重组和表达。
2.2 实验方法
2.2.1 银纳米粒子的合成
将三口烧瓶浸泡于高锰酸钾和浓硫酸的混合液中过夜,使用时将烧瓶清洗干净,除去杂质避免在合成过程中因 PH 过高或过低导致银单质的析出。在这里,胶体银的合成通过先前报道的改良的 Lee 和 Meise 的方法和 Xinyi Dong 等人的研究,通过柠檬酸钠合成胶体银,向其中加入氢氧化钠调节 PH 值来控制AgNPs 的粒径大小。取 33.4 mg 的硝酸银,倒入 250 mL 的三口烧瓶中,配成 200 mL 并加热到沸腾,将 1%的柠檬酸钠倒入 6 mL。1M 的氢氧化钠 20µL 倒入,直至颜色由变黄绿色。降至室温,期间不停搅拌,整个时间持续约 50 分钟至 90 分钟,便得到粒径均一,形状固定的稳定的银胶体溶液。利用 UV 光谱仪测得在 416nm 处有最大吸收峰,OD416nm=3.2。根据 Lambert-Beer 定律:A=kbc(A为吸光度,K 为摩尔吸光系数,此处值为 3×1011 M-1cm-1,b 为吸收层厚度,c=1 cm),根据此公式得到的胶体溶液浓度为 3.5×10-11 M。
2.2.2 dCas9 的重组表达及功能鉴定
dCas9 的重组表达同本实验室同学金正洋一起承担完成。
一、质粒转化及重组细菌扩大培养
(1)1 µL 的质粒被转化,然后挑开单克隆培养至含氨苄青霉素的 LB 培养基中 20 mL,37 ℃,200 rpm 培养过夜; (2)取 5ml,转移 LB 培养基中 500 mL,37 ℃下的 250 rpm 震荡培养; (3)IPTG 1 mM,15 ℃下的 200 rpm 震荡培养过夜; (4)4 ℃下的 20 min,1 L 离心瓶收集菌体 3400 rpm; (5)菌液重悬,离心收集菌体,用于超声破碎。
第三章 AgIMNPs 对双链 DNA 中 SYBR Green I 共振增强的影响 ....33
3.1 前言 ................................. 33
3.2 实验仪器与试剂 ........................ 33
第四章 AgNPs@dCas9/gRNA 探针对目标序列核酸检测的研究 ........51
4.1 前言 ................................. 51
4.2 实验仪器与试剂 ................................ 52
第五章 结论 .............................61
第四章 AgNPs@dCas9/gRNA 探针对目标序列核酸检测的研究
4.1 前言
基于临床表现,核酸的检测手段主要通过 qP CR。这种具有高灵敏和低样本量的优势目前逐渐取代传统的 PCR 技术成为主要的检测手段之一。随着近两年的发展,同样也出现了以环介导等温扩增 (LAMP) 为主的检测技术。通过四种特异性引物,可以在固定温度下进行扩增。然而,它们都需要多个步骤、操作时间长、引物设计复杂、需要大型仪器,扩增阶段导致的错配问题依然存在。为了克服 qPCR 的局限性,几种核酸传感方法已开发,例如逆转录重组酶聚合酶扩增(RT-RPA)、逆转录环介导的等温扩增 (RT-LAMP)和成簇的规则间隔短回文重复序列 (CRISPR)基于相关核酸酶 (Cas)的核酸检测方法。上述检测方法基本上通过改变温度或通过相应蛋白的参与将 DNA 解螺旋后与含有荧光标记的探针结合并进行检测。近些年,人们将关注点从捕获方式逐渐转移到如何展示“捕获”。对于 CRISPR 的相关核酸酶 (Cas)家族,将 Cas9 合成序列中的 RuvC1 和 HNH 两个区域突变可以得到 dCas9,只保留捕捉能力而失去剪切酶活性,被主要应用到核酸的捕捉工作中。表面增强拉曼技术已经广泛应用于生物传感当中。其高灵敏性、低检测限、高稳定性而被开发成各种生物分子的检测手段。
因此,我们报道了 CRISPR/dCas9 介导的表面增强拉曼散射 (SERS)直接测定 SARS-CoV-2 双链 DNA 的传感方式。设计银纳米颗粒,其表面被 dCas9 蛋白修饰并将其与 gRNA 组合成探针。gRNA 可以特异性结合靶 DNA 序列,最后,富集探针以形成热点。为了诊断 SARS-CoV-2,将 AgNPs@dCas9/gRNA 探针与N 和 Orf1ab 基因反应。在室温下,探针与靶序列结合。随后加入 SYBR Green I并立即进行拉曼检测。SYBR Green I 和 DNA 双链结合,在相同的激发光下,从 Orf1ab 和 N 获得更强 SERS 信号。这种传感方式的优点在于可以直接检测双链 DNA,不局限单链 DNA 或 RNA 的检测。
第五章 结论
本论文中在研究 DNA 样本的新型信号传感技术方面,使用具有共振增强作用 SERRS 可以获得稳定的核酸分子信号强度,与传统荧光技术相比,可以有效地避免光漂白和荧光淬灭带来的影响,较普通 SERS 检测提高了几个数量级。在传感元件优化方面,解决了银纳米粒子表面存在大量柠檬酸杂质的常见问题。利用 SERRS 无标记探针预混方式检测 VP72 质粒的最低检测浓度在 0.1 ng/µL,与使用试剂盒检测的最低先测浓度几乎相同。证明了对于应用该传感技术开发双链 DNA 病毒现场检测研究技术的可行性,可以为同类研究提供一定的借鉴意义。
在研究更直接有效的 DNA 捕获技术方面,相对于传统的退火结合方法,CRISPR/dCas9 在 sgRNA 的引导下可以对特定序列的双链 DNA 直接捕获,无需进行解链,不受限于目标 DNA 长度和二级结构对结合过程的影响,更加直接高效,并且这种 DNA 捕获技术可在常温下进行,无需退火结合的变温过程。最终基于 CRISPR/dCas9 介导 SERRS 直接检测 Orf1ab 和 N 基因的最低检测限浓度为 4×105 copies/µL 及 3000 copies/µL。
本文将所开发的 DNA 捕获技术和信号传感技术联用,完成了对非洲猪瘟和新冠病毒的标准序列的检测,证明了一定的技术可行性,打通了从“捕获”到“传感”的 DNA 检测流程,为相关技术开发提供了一定的借鉴。
参考文献(略)
