本文是一篇高校毕业论文,本论文运用了 FFA 诱导 LO2 细胞建立 NAFLD 模型。检测了给药 H4 之后细胞凋亡,生化指标(MDA、SOD、GSH-Px、AST、ALT 和 TG)的影响,以及相关蛋白(Bcl-2,Bax,phos-IkBα 和 phos-p65)的表达,推断出 H4 可以在细胞水平上通过减少脂质堆积,氧化应激和改善肝功能紊乱,另外还可以调节 Bax/Bcl-2和 NF-κB 信号通路来减少细胞凋亡和炎症发生,从而起到了保护由 FFA 诱导的LO2 细胞 NAFLD 损伤的作用。
第一章 H4 的全合成
1 合成背景
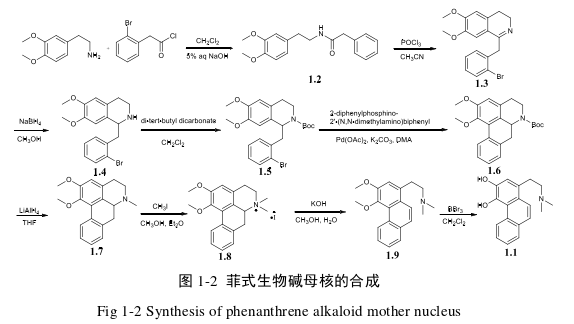
1.1 菲式生物碱母核的合成
2013 年,西班牙阿夫达巴伦西亚大学劳拉·莫雷诺课题组[78]以 8 步反应完成了 3,4-二羟基菲类生物碱 1.1 的全合成。他们以 3.4-二甲氧基苯基乙胺为起始原料,经过乙酰氯的酰胺化反应生成酰胺 1.2。随后通过三氯氧磷脱去一分子水环合,硼氢化钠还原双键,Boc 酸酐保护氨基生成得到 1.5。接着使用醋酸钯和二苯基磷酸二甲基胺联苯为催化剂脱去一分子溴化氢环合生成 1.6。然后使用氢化锂铝还原 Boc 为甲基得 1.7。再使用碘甲烷将 1.7 季胺化生成季铵盐得 1.8。1.8在氢氧化钾乙醇条件下发生霍夫曼降解反应生成 1.9。最终 1.9 在三溴化硼的作用下脱甲基生成 3,4-二羟基菲类生物碱 1.1。
2 实验材料与仪器
2.1 试剂
无水 N,N-二甲基甲酰胺、无水 N,N-二甲基甲酰胺、三氯氧磷、3-甲氧基-4-羟基苯乙胺盐酸盐、N,N-二异丙基乙胺、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐、1-羟基苯并三唑、邻溴苯乙酸、氯(2-二环己基膦基-2',4',6'-三异丙基-1,1'-联苯基)[2-(2'-氨基-1,1'-联苯)]钯(II)、二碳酸二叔丁酯、碳酸铯、2,3,4,6-四乙酰氧基-alpha-D-吡喃葡萄糖溴化物、碘化镁购于萨恩化学技术(上海)有限公司;
乙腈、二氯甲烷、乙酸乙酯、甲醇、丙酮、乙醇、氯化钠、甲苯、柱层析中性氧化铝(100 目-200 目)购于国药集团化学试剂有限公司;
氢氧化钠、37%甲醛溶液、氢氧化钾、无水硫酸钠、硼氢化钠、盐酸购于西陇科学有限公司;
碳酸氢钠、石油醚(60-90)购于天津市大茂化学试剂厂;
GF254 硅胶板、柱层析硅胶(200 目-300 目)购于青岛海洋化工有限公司; 四丁基溴化铵、甲醇钠购于阿拉丁。
所用试剂均为分析纯
第二章 H4 对 FFA 诱导的 LO2 细胞损伤的保护作用及初步机制研究
1 实验材料和仪器
1.1 细胞来源
人正常肝细胞(LO2,编号:135-XV-20)细胞株购于美国的组织细胞收藏中心。
1.2 实验材料
胎牛血清(FBS)购于美国 Hyclone 公司; DMEM 培养基、胰蛋白酶购于美国 GIBCO 公司; PVDF 膜、人血清白蛋白试剂盒购于美国 Millipore 公司; 丽春红、吐温 20、PMSF 购于美国 Solon 公司; 蛋白裂解液(RIPA)、Tris、MTT 试剂购于碧云天生物技术研究所; 凋亡试剂盒购于江苏凯基生物技术有限公司; 丙二醛(MDA)试剂盒、甘油三酯(TG)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒购于南京建成生物工程研究所; Anti-IκBα 抗体、Anti-phospho-IκBα 抗体、Anti-p65 抗体、Anti-phos-p65 抗体购于美国 CST 公司; Anti-Bax 抗体购于美国 Abgent 公司; Anti-Bcl‑2 抗体购于安诺伦生物科技有限公司。
2 实验方法
2.1 细胞培养
将 LO2 细胞培养在为含有青霉素-链霉素(100 U/mL)以及 10% FBS 的DMEM 培养基,当在显微镜下发现细胞覆盖面积为 90%左右时,用 PBS 清洗两次,加入 3 mL 胰蛋白酶,当观察到培养瓶中溶液变成白色浑浊并且有白色斑块脱落时,加入 3 mL 培养基,800 rpm,4℃,离心 5 min,吸去上清液,用培养液分散细胞,放入培养箱培养。
2.2 MTT 试验检测H4 对 LO2 细胞生长影响
对处于对数生长期的 LO2 细胞用 96 孔板进行种板,细胞的密度为以 1×105 cells/孔,置于培养箱中培养 24 h,后吸取上清液,加入不含胎牛血清 DMEM 继续孵育 12 h。将细胞分为 6 组,分别向 LO2 细胞中加入化合物 H4,使药物在培养基中的终浓度为 0、2.5、5、10、20、40 μg/mL,孵育 24 h。孵育结束前 4 h,每孔加入 5 mg/mL MTT 溶液 20 μL。孵育结束后,弃去各孔上清液,每孔加入150 μL DMSO,用摇床上摇匀 10 min,用酶标仪测定 OD570 nm。
2.3 FFA 诱导的 LO2 细胞损伤模型及分组
对处于对数生长期的 LO2 细胞用 6 孔板进行种板,于培养箱中培养 24 h。将细胞分为 control 组、FFA 组、H4-2.5(2.5 μg/mL)、H4-5(5 μg/mL)、H4-10(10 μg/mL)各浓度组。Control 组加入培养液 2 mL,FFA 组加入含有含有 1mM FFA(oleic acid: palmitic acid = 2:1)的培养液、H4 组分别加入含有 H4 和 1mM FFA 的培养液,使 H4 浓度分别为 2.5,5,10 μg/mL。置于 37 ℃,5% CO2条件下孵育 24 h。
2.4 细胞凋亡检测
孵育结束后,按照 2.3 中的分组情况收集 LO2 细胞置于流式管中,用 PBS洗涤细胞两次后,每管加入 0.5 mL 染色缓冲液重悬细胞,再加入 5 μL FITC 染液,混匀,避光孵育 15min 后加入 5 μL PI 染液,孵育 5 min 后进行上机检测。
第三章 H4 对高脂饲料诱导的小鼠 NAFLD 模型的保护作用及机制研究 .. 41
1 实验材料和仪器 ...................................... 41
1.1 实验动物 .................................. 41
1.2 实验试剂 ............................ 41
第四章 总结与展望................................. 51
3 实验结果
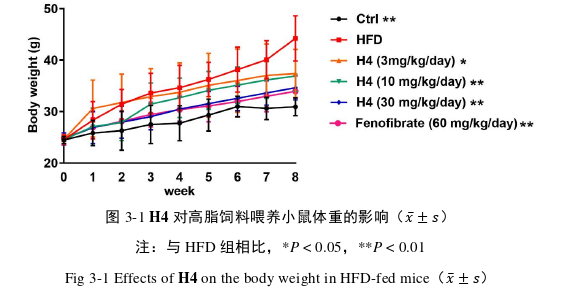
3.1 H4 治疗后对体重的影响
从图 3-1 所知,给药 8 周之后,与 Ctrl 组相比,HFD 组小鼠体重显著上升;与 HFD 组相比,H4 各组和 Fenofibrate 组小鼠体重显著下调。提示 H4 能减缓由于高脂饲料引起的小鼠体重增加。
病理组织学检查是诊断 NAFLD 及判断其后续发展的标准。如图 3-2 所示,Ctrl 组小鼠肝脏细胞排列整齐,无脂滴,无炎性浸润;HFD 组小鼠表现出严重的水泡样变性和大泡性脂肪变性,肝脏细胞索排列紊乱,并出现炎性浸润;H4 各组和 Fenofibrate 组对比 HFD 组,肝脏细胞索排列相对正常,无明显的脂肪变性。提示 H4 可以减少由 FFA 引起的肝组织脂质沉积。
第四章 总结与展望
中药小花清风藤,作为保肝类药物,用于肝损伤的治疗。其中 H4 是从小花清风藤中分离出来的一个新的生物碱苷类化合物,通常生物碱是该植物的活性成分。本论文从 3-甲氧基-4-羟基苯乙胺盐酸盐为原料,经过 12 步化学有机合成,最终合成出 H4。并以此为基础探讨 H4 在体内外抗非酒精性脂肪肝的作用及其机制。
1. 首先我们对目标化合物 H4 进行解析,查询资料,设计实验路线。最终我们以 3-甲氧基-4-羟基苯乙胺盐酸盐为原料,先后进行了酸胺缩合反应,环合反应,硼氢化钠还原反应,Boc 保护胺基反应,Heck 反应,脱保护基 Boc 反应,埃施魏勒-克拉克反应,季铵化反应,霍夫曼消除反应,柯尼希斯-克诺尔苷化反应,脱保护基甲基反应和脱保护基乙酰基反应,一共 12 步反应最终合成出 H4。
2. 运用了 FFA 诱导 LO2 细胞建立 NAFLD 模型。检测了给药 H4 之后细胞凋亡,生化指标(MDA、SOD、GSH-Px、AST、ALT 和 TG)的影响,以及相关蛋白(Bcl-2,Bax,phos-IkBα 和 phos-p65)的表达,推断出 H4 可以在细胞水平上通过减少脂质堆积,氧化应激和改善肝功能紊乱,另外还可以调节 Bax/Bcl-2和 NF-κB 信号通路来减少细胞凋亡和炎症发生,从而起到了保护由 FFA 诱导的LO2 细胞 NAFLD 损伤的作用。
3. 运用了 HFD 喂养小鼠建立 NAFLD 模型。检测了给药 H4 之后,对老鼠体重,血清生化指标(TG、TC、HDL-C、LDL-C、AST、ALT、ALP、LDH 和GGT),肝病理学切片(HE 染色、油红 O 染色)以及肝组织中生化指标(MDA,GSH-Px 含量和 SOD)等的影响。药效结果显示,H4 对抗 NAFLD 有显著的作用。另外还检测了相关蛋白(Bcl-2,Bax,phos-IkBα 和 phos-p65)的表达,其结果与细胞水平上的结果有一致性。推测 H4 在体内体外可以通过调节 Bax/Bcl-2和 NF-κB 信号通路来减少细胞凋亡和炎症发生,从而改善由 NAFLD 造成的脂质堆积,氧化应激和肝功能紊乱。
参考文献(略)
