Imposex equals to masculinization?
Abstract
Tributyltin(TBT)which has been widely used as antifouling paints for ships and fishing nets can cause gastropod to be affected by imposex .Take Haliotis diversicolor as an example, chronic exposed to TBT with polluted environmental concentration, the effects of biotransformase and metabolizase activities were conduced by the accumulation of the total Sn, which might be main caustion of morphological /changes of digestive gland and gill. The endocrine disruptions were led to by the changes of sex hormone, which resulted in the aberrance of gonad. While many field studies have already demonstrated the negative impact of tributyltin(TBT) upon female gastropods , the difference between imposex and sex change has not yet been fully described. The purpose of this study was to verfify this important question.
Keywords: tribulyltin chloride; Haliotis diversicolor; imposex; sex change
TBT是一种已知的内分泌干扰物,特别是在引起腹足类的性畸变,但个别文献曾报道它引起雄化,本实验选用了腹足类前鳃亚纳中的性发育前期的发育中的杂色母鲍做实验,分别在**染毒**天,分别检测性畸变的水平和组织学变化水平,发现雄性激素浓度变化不大。从组织学角度来看,有大量的残留,经电镜观察为脑黄蛋白的残留,不会发生雄化现象。
1: Introduction
As we all know, organotin compounds, such as tributyltin(TBT),has been used in antifouling paints for large boats over the years.
Organotin compounds, especially tributyltin(TBT),have been widely used all over the world for the property of protecting large boats and fishing nets. However, this has severely affected many species /of marine organisms,such as plankton, shells and fishes.
Moreover,the most striking effect of TBT as a hormonal disrupter is the development of male organs in gastropod females now known as imposex. this can lead to reproductive failure and death. So it has been described as one of the most damaged compounds in the seaworld.
However ,little information has been focused on the the difference between imposex and masculinization.
有机锡作为目前观察到唯一明确能影响到群落变化的内分泌干扰物质,造成海产腹足类的性畸变现象,其主要来源是来自船舶的防污涂料。
(ⅰ)性畸变(imposex)的概念的提出:Blaber (1970)年首次在英国Plymouth sound的狗岩螺(Nucella lapillus)中发现海产腹足类的性畸变现象,即在雌性个体中发育出不正常的雄性特征,包括雄性生殖器官的形成及输卵管的卷曲。这种畸形发育导致输卵管的堵塞,阻碍卵囊的释放和受精的完成,从而使得种群内雌性个体数量减少,繁殖率下降,种群老龄化,最终导致种群衰退和区域性绝种。Imposex一词最初由Smith(1971)引入,用以描述上述现象。其中,impo-表示强加的意思,sex为性别,imposex表明在一种性别的个体上叠加相反性别特征的现象。
(ⅱ)性畸变与有机锡污染的因果关系。Smith等(1980)发现一种织纹螺Nassarius obsoletus性畸变现象与船舶活动有关;Bryan等(1986)通过大量的野外调查和对螺体内的重金属检测证实,螺类性畸变与锡含量密切相关;野外调查还表明,狗岩螺性畸变程度与水体TBT含量具有良好的相关性(Bailey & Davies,1989)。为了进一步证实性畸变是由有机锡引起的,英国科研人员开展了一系列的室内实验(Bryan等,1987,1988;Gibbs等, 1988),结果表明,最敏感的狗岩螺在不到1ng Sn/L的TBT下就会产生性畸变;台湾的刘莉莲等在实验室中将60 ng Sn/L的TBT注射于荔枝螺 (Thais claigera) 体内,其雌螺长出阴茎的长度较注射20 ng Sn/L的TBT个体的阴茎长,显示TBT有促进性畸变作用(Liu & Suen,1996)。可以说,TBT对生殖系统的毒性作用已经得到了广泛的共识和重视。
(ⅲ)性畸变的种类。腹足纲(Gastropoda)属软体动物门(Mollusca),明显分为头、足和内脏团三部分。头部发达,左右对称,具触角一对,足部左右对称。腹足纲又分为前鳃亚纲(Prosobranchia)、后鳃亚纲(Opisthobranchia)和肺螺亚纲(Pulmonata),其中只有前鳃亚纲是雌雄异体,其余两个亚纲都是雌雄同体。前鳃亚纲分为原始腹足目(Archaeogastropoda)、中腹足目(Mesogastropoda)和新腹足目(Neogastropoda)。
尽管腹足纲总共有88000 种,但并不是每种都会发生性畸变。首先,有可能发生性畸变的只能是雌雄异体的前鳃亚纲的种类;其次,通常对性畸变的判断基于雌性个体是否形成阴茎和输精管,这意味着只能发生在交尾的类型,即中腹足目和新腹足目。按照最新的资料统计全世界发生性畸变的种类至少有168 种,分布如下:中腹足目仅33 种,新腹足目骨螺科62 种,蛾螺科20 种,芋螺科14 种(施华宏,2003b)。
(ⅳ) 性畸变和性逆转(雄化)有本质上的不同。首先,从起源上看,性畸变是由于人为污染造成的,只是二十世纪七十年代才开始发现,而性逆转是生物界的一种自然现象,鱼类中就有黄鳝,腹足类中坩埚螺(Crucibulum)、履螺(Crepidula)也存在性逆转现象;其次,从发展过程来看,性畸变是在原有的雌性器官的基础上形成雄性器官,雌性器官并没有消退,而性逆转发生后,原有的性别特征逐渐消失;最后,从结果来看,性畸变严重时导致雌性个体不育,而性逆转并不影响生殖功能。
中腹足目和新腹足目的大多数种类雄性个体具有交配器官,性畸变用肉眼或解剖镜下就可以观察到,而原始腹足目只有性腺差别而没有交配器官,因此,要原始腹足目定义性畸变就显得十分困难。要观察原始腹足目的性畸变现象,则必须对其性腺进行切片观察,增加了辨别难度。目前国内外关于有机锡对原始腹足目的性畸变研究得很少,日本的Horiguchi等 (2000,2002)研究了盘大鲍(Haliotis madaka)及大鲍(Haliotis gigantea)两种鲍的性畸变现象,还在实验室以 浓度TBT养殖盘大鲍(Haliotis madaka),声称造成了雄化。
除腹足类外,也发现有机锡造成其他贝类性转变,国内的李琪等(2001)发现了三丁基氧化锡造成太平洋牡蛎(Crassostrea gigas)雌雄同体的现象。
海洋软体动物对有机锡的敏感范围较广。Thain(1983)指出,当水体中TBT的浓度达到0.02~0.11 μg/L时太平洋牡蛎(Crassostrea gigas) 幼体的生长将被抑制,而且其壳体变厚,软组织结构改变。TBT对牡蛎幼体的96h的LC50仅为0.7 μg/L(Alzieu,1986)。在70年代末,又发现法国的阿卡琼湾(Arcachon)的太平洋牡蛎贝壳增厚成球形的现象,牡蛎养殖业因三丁基锡的污染而一度陷于瘫痪,直接经济损失近1.5亿美元(Alzieu等,1991)。实验证明,0.15 ng/L TBT便可以导致C. gigas 贝壳增厚,1.6 ng/L时严重抑制牡蛎生长,牡蛎对TBT的富集系数高达104(Waldock & Thain,1983)。
此外,自上世纪70年代以来,日本的野生鲍出现了明显的种群数量减少的现象,通过采取人工增殖和海区放流等措施使种群数量略有增长,在神奈川等海域发现捕获的鲍95%来自放流的人工养殖鲍(Imai等,1996)。造成这一现象的原因,Horiguchi等(2000)认为是由防污涂料中含的有机锡扩散到海区引起鲍的种群衰退。Horiguchi(1998)还做了有机锡对盘鲍(Haliotis discus discus)和盘大鲍(Haliotis madaka)两种鲍的急性毒性实验,结果如下所示:
(V)有机锡造成性畸变的机理
Spooner等(1991)将雌性狗岩螺(Nucella lapillus)幼体放入TBT浓度为40 ng Sn/1的海水中,结果阴茎较对照组增长,在实验28天后发现,类固醇中睾酮水平明显上升。用睾酮直接注射没有受TBT污染的雌螺,结果产生了与TBT污染同样的效果。这表明,TBT通过增加螺体内的睾酮(testosterone;T)水平来诱导性畸变发生的。他们还推测,TBT能抑制负责将睾酮转化为雌二醇的芳香化酶(aromatase)的活性。
但Ronis等(1996)认为,TBT与睾酮竞争细胞色素P450-依赖芳构化酶而抑制睾酮代谢的作用不明显,TBT应该是通过阻塞睾酮与活性代谢物的硫络合作用(及其伴随的排泄作用),造成睾酮与活性代谢物等雄性激素的堆积而诱导性畸变的。
Feral等人(1983)则认为,性畸变受侧神经节(pedal ganglia)释放的一种神经介质的诱导,而TBT能作用于侧神经节,改变神经介质水平,从而诱导性畸变的发生。Oberdörster等(1998,2000)经过研究野外性畸变个体、室内药物诱导产生性畸变的个体和正常雌性个体睾酮的代谢水平,结果发现野外采集的性畸变个体的代谢有别于实验组,因此,他们提出,除了芳香酶抑制能诱导产生性畸变之外,也应该存在其他的机制,尤其是腹足类的神经中枢,它能随TBT的升高引起阴茎和输精管的产生。
2. Materials and methods
2.1 materials
实验用杂色鲍(Haliotis diversicolor)购自福建省漳浦古雷半岛养殖场,先在室内养殖池用沙滤海水暂养十天,选取活力好,体长5~6 cm,体重22~25 g的个体进行污染实验。
2.2 experimental conditions and dosing
仪器采用752型分光光度计,Beckman DU—8B紫外—可见分光光度计,VARIAN Cary elipse荧光分光光度计,BeckmanJ2—MC型高速冷冻离心机,CEM公司的MSPl000型微波样品处理系统,北京吉大小天鹅仪器AFS-930型双道原子荧光光度计,日本产Agilent 7500i型电感耦合等离子体质谱仪,JEM-100CXⅡ电子透射显微镜。
锡标准溶液(0.5 mg/ml)由国家标准物质研究中心提供;三丁基氯化锡由国际虹鼎(南通)化工有限公司惠赠,含量为98%;NADPH,ethoxyresorufin,resorufin为Sigma公司产品;优级纯HNO3(福州市化工研究所)和H2O2(江阴市化学试剂厂);其他试剂为国产分析纯试剂;超纯水由Milli-Q装置(电阻率>18 MΩ)处理而得。
2.3methods
2.3.1 污染实验
三丁基氯化锡(TBT)先用无水乙醇配制成一定浓度的储备液,避光于4 ℃保存,实验前用砂滤海水分别配制成0、0.1、1、10和100 ng Sn/L五种浓度。乙醇的终浓度为0.05 ml/L海水。
随机选取雌性杂色鲍分为六组,并同时设平行组。每组约30个鲍,置于含60 L沙滤海水的玻璃箱中,充气机24 h充气,避光饲养,每3 d投喂江蓠(Gracilaria verrucosa)或海带(Laminaria japonica)一次,并于投喂次日清除食物残渣。每日更换相同浓度的污染液,并清除排泄物,实验期间水温18~24 ℃,pH为8.04~8.1,海水盐度29~32。实验用砂滤海水经双道原子荧光光度法测定,总锡未测出,仪器说明书检测限为10-11g/L。
污染实验开始后的第2、6、14、26、44、64 d采样,64 d后将污染液全部换成清洁沙滤海水进行为期20 d的恢复实验,恢复期第8、20 d采样,采样前一天停止喂食。采样时先用6号针头对准鲍腹足血窦位置抽取2ml血淋巴液,再仔细分离鳃、消化腺、性腺和肌肉,双蒸水清洗后用1.5 ml eppendorf管装取,肌肉用5 ml管装取。每个采样时间各浓度组采集样品6个,-80 ℃冰箱保存至测定。由于100 ng/L组在染毒末期杂色鲍剩余数量不足,所以该浓度组没有恢复期数据。
2.3.2 性腺预处理
取0.2~0.3 g性腺组织(精确称重到0.001 g,湿重)于1.5 ml eppendorf管,加入1ml无水乙醇,用小玻璃棒将组织捣碎,用旋涡混合器混匀,台式离心机5,000 r/min离心10 min后,取上清液倒入另一eppendorf管内,置于干燥皿内用真空泵抽气48 h,直到管内液体蒸发完全为止,盖上盖子于4 ℃下保存,待进行性激素测定时,加磷酸缓冲液0.5 ml进行稀释。
杂色鲍血淋巴液和性腺中睾酮和雌二醇的浓度水平用放射性免疫测定(RIA)方法,雌二醇和睾酮的放射免疫试剂盒由北京福瑞生物工程公司提供,雌二醇抗体与雌三醇、睾酮和孕酮均无交叉反应,检测范围为5~500 pg/ml;睾酮抗体与雌二醇、雌三醇和胆固醇交叉反应小于0.1%,检测范围0.05~10 ng/ml。
测定方法按照放射免疫试剂盒操作说明书操作,首先用激素不同浓度的标准品或样品0.5 ml与123I-T标记物及抗血清等37 ℃下混匀、温育1 h后,混匀,室温静置15 min,离心(3500 r/min)20 min,吸弃上清液,测定各管沉淀的放射性计数(cpm)。最后计算各标准管的百分结合率,绘制的半对数标准曲线,样品管浓度可根据百分结合率从标准曲线上查出。
TBT暴露64 d后取各浓度组性腺末端角锥处和左鳃中段靠前的组织修剪成约1 mm3大小,2.5%戊二醛在4 ℃下固定保存,用1%锇酸后固定1 h,2%醋酸双氧铀块染,系列酒精脱水,环氧树脂618渗透包埋,超薄切片之前先用半薄切片定位,光镜下找到所需部位,再用LKB-11型超薄切片机切片,饱和醋酸铀和柠檬酸铅双重染色,JEM-100CX11透射电镜观察及拍照。
3. results
TBT暴露对杂色鲍消化腺和性腺显微结构的影响
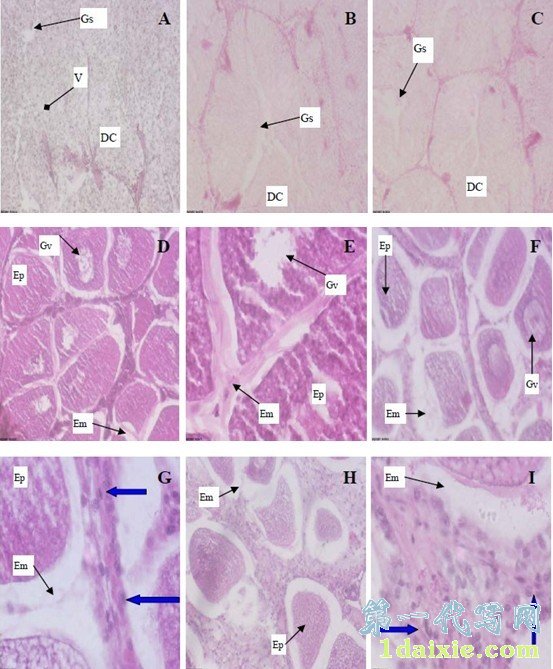
图版说明
DC:消化细胞(Digestive cell),V:囊泡(Vesicle),Gs:腺管腔(gland cavity space)
Em:卵膜(Egg membrane),Gv:胚泡(Germinal vesicle),Ep:卵质(Egg plasm)
A:对照组消化腺组织切片(x100),示正常消化细胞、囊泡和腺管腔;
B:10 ng/L浓度组消化腺组织切片(x100),示扩大的腺管腔;
C:100 ng/L浓度组消化腺组织切片(x100),示扩大的腺管腔;
D: 对照组性腺卵母细胞(x100),示正常卵母细胞及其胚泡和卵膜间隙;
E: 对照组性腺卵母细胞(x400),示正常卵母细胞及其胚泡和卵膜间隙;
F:10 ng/L浓度组性腺卵母细胞(x100),示扩大的卵膜间隙及条带;
G:10 ng/L浓度组性腺卵母细胞(x400),示扩大的卵膜间隙及条带内颗粒物(蓝色箭头);
H:100 ng/L浓度组性腺卵母细胞 (x100),示异常卵母细胞、扩大的卵膜间隙及条带;
I: 100 ng/L浓度性腺卵母细胞(x400),示卵膜间隙条带及其颗粒物(蓝色箭头)。
TBT对雌性杂色鲍性腺显微结构的影响
繁殖期内杂色鲍的性腺十分庞大,位于身体右边,覆盖于内脏团的大部分表层,尤其在消化腺末端的角锥处发育最好,雌性杂色鲍性腺呈粉红色。
(i) TBT对雌性杂色鲍性腺显微结构的影响
在本研究中,在对照组中观察到性腺卵母细胞正常,在光镜(LM)下观察鲍的卵巢切片,成熟的初级卵母细胞呈圆形、椭圆形等多种形态,排列整齐并由一支细的卵柄附于生殖上皮上,卵质均匀,中央有一大而透亮的卵圆形的胚泡(Germinal vesicle),即为卵核(Egg nucleus),卵核约占整个初级卵母细胞的2/3,其长径为90~100 μm,短径为65-75 μm。由于卵母细胞直径较大,一般都有切片的刀痕,卵膜之间透明,而且间隙小,见图版I-D,E;在10 ng Sn /L浓度组中,性腺卵母细胞卵径开始变小,观察到有卵核的卵母细胞数量减少,卵核不再透亮,卵黄致密,较少出现切片刀痕,卵膜之间开始出现间隙,间隙中间开始出现较窄的条带状组织,中间含有许多圆点状和长椭圆或长圆形染色较深的颗粒物,见图版I-F,G;在100 ng Sn /L浓度组中,性腺卵母细胞卵黄径继续变小,几乎观察不到有卵核的卵母细胞,卵核也不再透亮,卵黄致密,几乎不会出现切片刀痕,卵膜之间间隙甚至超过卵母细胞,而且间隙中间颗粒物组成条带变宽,条带中开始出现大量的圆点状和少量的长椭圆或长圆形染色较深的颗粒物,颗粒物增多,见图版I-H,I。
(ⅱ) TBT染毒64 d后雌性杂色鲍性腺卵母细胞最大直径的变化
N=100 *表示与对照组比较有显著差异 **表示与对照组比较有极显著差异
图3-18 TBT暴露64 d后对雌性杂色鲍性腺卵母细胞最大卵径的影响
Fig3-18 Effect of maximal diameter of ovum in gonad of Haliotis diversicolor exposed to TBT for 64 days
从图3-18可以看出:在TBT染毒64 d后,0.1 ng/L浓度组卵母细胞最大卵径比对照组有所缩小,但没有显著差异;中浓度组随着浓度的增加卵母细胞最大卵径比对照组有所增加,其中1 ng/L组呈显著差异;而高浓度组随着浓度的增加卵母细胞最大卵径比对照组有所缩小,100 ng/L组显现出与对照组极显著差异。这种变化趋势与图3-15中64 d雌二醇水平剂量-效应图十分吻合。
TBT对雌性杂色鲍性腺超微结构的影响
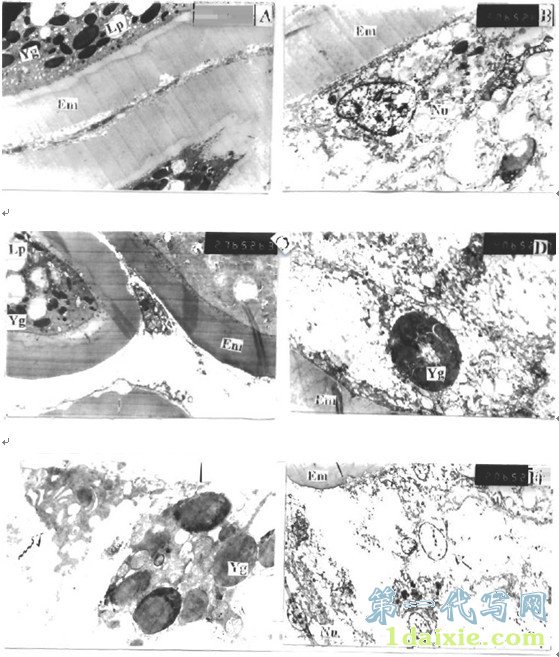
图版 Ⅱ Plate Ⅱ
代写职称论文Em:卵膜(Egg membrane) Yg:卵黄颗粒(Yolk granules) Lp:脂滴(Lipid droplet)
N:细胞核(Nuclei) Nu:核仁(Nucleolus)
A:对照组性腺卵母细胞(x2,700),示正常卵母细胞卵膜及其间隙;
B:1 ng/L浓度组性腺卵柄细胞(x5, 000),示细胞核染色体凝聚及颗粒分布;
C:1 ng/L浓度组性腺卵母细胞(x2,700),示卵母细胞卵膜间隙及其内部结构;
D:10 ng/L浓度组性腺卵母细胞(x40, 000),示卵膜外围卵黄颗粒物质内部结构;
E:100 ng/L浓度组性腺卵母细胞(x14, 000),示卵膜间隙卵黄颗粒及网状支持结构(箭头);
F:100 ng/L浓度组性腺卵柄细胞(x2, 000),示卵柄细胞细胞核空洞。.
由于在雌性杂色鲍性腺组织切片中观察到高浓度组卵膜间隙有存在大量的圆点状和少量的长椭圆或长圆形染色较深的颗粒物,超微结构上本研究重点观察颗粒物及卵柄细胞的超微结构变化。
从本研究结果看出,鲍正常的成熟卵为均黄卵,卵黄颗粒(Yolk granules)均匀分布在整个卵质中。卵黄颗粒的大小不等,小的直径仅0.5 μm,大的可达10 μm之多,其分布区域也略有不同,较小的卵黄颗粒分布在卵的中央部,较大的则分布在卵的外周部。卵母细胞充满了电子密度很高的卵黄颗粒和电子密度很低的油球或称脂滴(Lipid droplet),两者都有膜包裹,卵母细胞内有中等电子密度的网状支持结构;卵膜与卵质结合紧密,卵膜电子密度较低,约15-20 μm厚,卵母细胞之间间隙较小,间隙中无异常结构。(图版Ⅱ-A)
从图版Ⅱ-B中可见,1 ng/L浓度组卵母细胞卵膜外围卵柄细胞的细胞核有染色体凝聚现象,细胞质中并伴有少量电子密度很高的颗粒分布;
图版Ⅱ-C中可见,1 ng/L浓度组卵母细胞卵膜间隙有所扩大,在间隙中有些地方还出现电子密度较大的结构,表明性腺已开始出现畸变现象;
图版Ⅱ-D中可见,10 ng/L浓度组卵母细胞卵膜外围出现一些散落的卵黄颗粒物质,颗粒内并没有具体的二级结构,只观察到其中心有电子密度较低的空洞和纹理;
图版Ⅱ-E中可见,100 ng/L浓度组卵母细胞间隙散落的卵黄颗粒数目大量增加,外有一层无定形膜包裹,并有聚集成团的现象,有些颗粒物一端有月牙状的加厚,周围还有网状支持结构;
图版Ⅱ-F中可见,100 ng/L浓度组卵母细胞卵膜外围卵柄细胞还出现细胞核核仁消失,染色质减少的现象。
4.Discussion
TBT暴露对雌性杂色鲍性腺的形态畸变效应
Horiguchi等(2000)将盘大鲍(Haliotis madaka)从清洁的长崎对马岛海域转移到有机锡污染严重的神奈川码头海域进行笼养的实验,观察到污染海域雌鲍卵巢组织周围包围着具有精巢特征的组织,在七个月的野外转移实验后,卵巢内有精子发生(见图4-2);Horiguchi等(2002)还通过用100 ng Sn/L的TBT和TPT对大鲍(Haliotis gigantea)进行两个月的暴污实验后,发现初级卵母细胞呈现显著收缩现象,组织切片中还观察到两种未知类型的细胞,认为雌性鲍的卵巢内出现了精细胞、精子及产精管状结构(见图4-3),雄性鲍在有机锡污染下未发现性畸变现象,他还认为鲍和其他腹足类性畸变的不同在于雌鲍不产生输卵管和阴茎。
然而本研究也通过性腺组织切片观察到与上述日本的大鲍和鲍盘的性畸变相似的现象,在10 ng/L浓度组就观察到卵母细胞呈现显著收缩,卵膜间隙开始变大,而且出现大量圆点状和小量长椭圆或长圆形染色较深的颗粒物,在100 ng/L浓度组这一现象更加显著,卵母细胞的最大直径从172 μm缩小到128 μm,卵膜间隙继续变大而且间隙中间颗粒物组成条带变宽,颗粒物增多,有了文献相关报导,本研究起初也认为是变异的精细胞和精子,但在随后的电镜观察中发现颗粒物内部并没有二级结构,只发现有些颗粒物一端有月牙状的加厚,更没有发现任何杂色鲍精细胞或精子的主要特征,如顶体、纺缍形的细胞核、6个大型特化的线粒体和一对埋于线粒体中的中心粒、尾鞭中轴丝的“9+2”微管结构等(柯才焕,2003);而且到目前为止,除了Horiguchi外,并没有文献报导发现了腹足类性畸变伴随精细胞或精子的出现,Oberdörster等(2000)认为性畸变只是诱导产生雄性的附性器官(ASO)包括精导管(sperm duct)、曲精管(seminal vesicle)、外精沟(external sperm groove)和阴茎(penis)等的形成,并非直接产生精巢(testis)和精子(spermatozoon),而原始腹足类本身并没有这些附性器官,因此,其有关雌鲍在有机锡污染下卵巢中发现精细胞或精子的现象有待进一步探讨。
图4-2 7个月野外转移实验雌性盘大鲍(Haliotis madaka)的性腺切片
(引自Horiguchi等,2000)
Fig.4-2. (a) Ovarian tissue surrounded by a small testis (ovo-testis) in an abalone from Jogashima (April 1996) (X100 stained with hematoxylin-eosin). (b) Spermatogenesis in the ovary of female abalone, after the 7-month in situ exposure experiment using abalone from Tsushima caged near a dockyard in Jogashima (X400; stained with hematoxylin-eosin). O: oocyte after yolk globule accumulation; sp:spermatozoon.
图4-3 100 ng Sn/l TBT和TPhT暴露2个月后大鲍(Haliotis gigantea)的性腺切片
(引自Horiguchi等,2002)
Fig. 4-3. Spermatogenesis observed in the ovaries of female Haliotis gigantea exposed to either 100 ng TBT/l or 100 ng TPhT/l for 2 months (stained with hematoxylin–eosin). (a) Spermatozoa (black arrows) in the ovary of a female H. gigantea exposed to TBT; (b) spermatozoa (black arrows) and spermatids (white arrows) observed in the ovary of a female H. gigantea exposed to TPhT; (c) seminiferous tubule-like structures (a black arrow), a contracted primary oocyte (a blue arrow) and injured primary oocytes (white arrows) observed in the ovary of a female H. gigantea exposed to TPhT.
根据观察结果,从超微结构上看,我们初步判断该颗粒物为散落到卵母细胞间隙的卵黄颗粒(Yolk granules),与卵母细胞内的卵黄颗粒无论形态、大小、电子密度还是内部结构都基本一致。动物的卵黄根据化学性质可以分为蛋白质卵黄、碳水化合物卵黄和脂肪卵黄三种;根据卵黄发生途径可分为从卵母细胞本身合成,即自体合成,在卵母细胞以外的地方合成,然后进入卵母细胞,即异体合成两种。蛋白质卵黄和脂肪卵黄主要为卵黄细胞合成,其中脂肪卵黄粒全部由细胞器合成,蛋白质卵黄粒大部分由细胞器合成,其余由卵质中的卵黄蛋白直接聚合而成;碳水化合物卵黄主要是细胞外合成,由卵泡细胞合成并输送到卵周隙内,卵母细胞再经微呑饮作用摄入,合成外源性卵黄粒。研究表明对于大型甲壳类如长毛对虾(Penaeus penicillatus)、南美白对虾(Penaeus vannamei)和中华绒螯蟹(Eriocheir sinensis)的卵黄有两种来源(洪水根等,1992;姜永华,2003;堵南山等,1999),锯缘青蟹(Scylla serrata)卵黄发生则是以细胞外合成为主(成永旭等,2002);对于贝类则在双壳类研究较多,已观察到许多软体动物如文蛤(Meretrix meretrix)、青蛤(Cyclinaa sinensis)、缢蛏(Sinonovacula constricta)、太平洋牡蛎、僧帽牡蛎、栉孔扇贝和合浦珠母贝(Pinctada fucata)等,其卵母细胞通过微吞饮活动吸取外源卵黄物质,即外源物质通过微绒毛管腔以吞饮泡形式输送到卵母细胞,作为合成卵黄粒的原料(应雪萍,2002;曾志南和李复雪,1991;上官步敏和刘正琮,1995;任素莲等,1999;林加涵和汪德耀,1983;刘德模和洪水根,1996;沈亦平和张锡元,1993)。但未见鲍卵黄发生来源的报导。实验观察到的散落在卵母细胞间隙的卵黄颗粒,推测是由于TBT破坏了卵母细胞的微呑饮作用,使碳水化合物卵黄滞留在卵膜间隙内退行性变化造成,另一可能性是衰败的卵母细胞退行性变化,卵黄颗粒无法被完全吸收而滞留卵膜间隙造成的,Horiguchi等(1998,200)观察到卵膜间隙的两种未知类型的细胞应该也属于这种情况,这一推测有待于通过组织化学检测的方法来进一步证实。这种由于卵黄颗粒散落卵膜间隙的性腺畸变类型目前为止未见任何相关的文献报导。
有关有机锡对贝类性成熟影响的报导很少。在鱼类方面,虾虎鱼(Aboma lactipes)经1.99 μg/L的TBTO暴露24周后,卵黄积累受到阻碍(小山次郞和清水昭男,1992);刺鱼(Gasteroteus aculeatus)在0.19-0.99 μg/L的TBTO暴露7个月后,观察到退化变性卵增加,GSI(生殖腺体重比)增长受到抑制(Holm等,1991)。这两篇文献说明了有机锡会对卵细胞特别是卵黄造成影响,也从另一个侧面证实了本研究的观察结果。
目前,除了Horiguchi等报导有关雌鲍在有机锡污染下卵巢中发现精细胞或精子的现象外,其他关于污染物引起贝类性转变或间性(intersex)的报导都集中在双壳类,Dolgov等(1991)报导了在中国南海石油污染的环境压力可能诱导珠母贝(Pinctada margaritifera)发生性转变;李琪等(2001)报导了1 μg/L三丁基氧化锡(TBTO)造成了太平洋牡蛎(Crassostrea gigas)雌雄同体的现象,卵母细胞的直径增长受到抑制,卵黄蛋白含量减少,卵巢中RNA/DNA比降低,而精巢变化不显著。
在性腺显微观察中,10 ng/L和100 ng/L浓度组出现了卵细胞间隙增大,间隙中还有许多椭圆或长圆形染色较深的颗粒物,而对照和低浓度组则是卵细胞间隙致密,中间无颗粒物;从电镜观察卵细胞间隙中颗粒物得知,颗粒物并无二级结构,没有典型的精细胞特征,该颗粒物实际上是一种卵黄颗粒。由于TBT暴露使卵黄滞留在卵膜间隙内退行性变化造成性腺畸变,从而表现出生殖毒性。与大多数双壳贝类的受精卵在受精后24小时左右即可发育为能主动摄取外源食料的D形幼虫相比,鲍的受精卵在受精72小时后才能发育为能摄取外源食料的匍匐幼虫,而在此之前,则完全靠自身的卵黄颗粒营养(王如才等,1993)。因此对鲍而言,卵子中卵黄更具有重要意义。低浓度的TBT造成卵黄的吸收不足,使卵子自身和早期胚胎进一步发育的能量缺口增大,即使受精后也可能因为营养不足而造成幼虫停止生长或死亡,这可能是有机锡引起自然和人工养殖鲍种群衰退的直接原因。
总之,TBT通过神经内分泌改变了性激素水平,特别是造成了睾酮和雌二醇之间比例失衡,从而破坏杂色鲍外源性卵黄颗粒的吸收,表现出卵黄颗粒散落卵膜间隙类型的性腺畸变,使卵母细胞发育受到影响,表现出生殖毒性,进而引起种群衰退。
1. TBT暴露对雌性杂色鲍性腺睾酮含量的影响
表3-2显示,性腺中睾酮水平在实验进程中基本表现出先降后升再降的变化趋势,下降的时间大都集中在26~44 d之间,恢复期20 d中高浓度组都有所下降,并没有明显的时间-效应和剂量-效应关系;在中高浓度组的染毒的末期(64 d),睾酮含量有较大幅度的增长,但由于饲养期间个体差异较大,与对照组相比并没有表现出显著差异,但与低浓度相比表现出极显著差异。
表3-2 TBT暴露对杂色鲍性腺睾酮含量的影响
Tab3-2 Effect of TBT exposure on estosterone in the grand of Haliotis diversicolor
时间 对照组 0.1 ng/L 1 ng/L 10 ng/L 100 ng/L
2 d 0.18±0.10 0.60±0.63 0.67±0.56 0.37±0.17 0.21±0.15
6 d 0.09±0.03 0.13±0.13 0.79±0.04 0.15±0.13 0.56±0.41
14 d 0.25±0.20 0.51±0.47 0.98±1.59 0.21±0.10 0.79±1.13
26 d 0.39±0.66 0.15±0.06 0.27±0.23 0.07±0.07 0.17±0.15
44 d 0.13±0.01 0.24±0.16 0.10±0.04 0.17±0.13 0.81±0.56
64 d 0.94±0.69 0.36±0.32 1.38±1.43 1.31±0.35aabb 1.01±0.14 aabb
84 d 0.20±0.17 0.56±0.55 0.54±0.54 0.80±0.50 -----
睾酮浓度单位为ng/g wet weight 84 d为恢复期第20 d n=4-6
aa表示与对照组比较有极显著差异 bb表示与0.1 ng/L组比较有极显著差异
2.TBT暴露对雌性杂色鲍雌二醇含量水平的影响
从图3-14中显示,低浓度组(0.1 ng/L)中在26 d前性腺雌二醇含量变化趋势与对照组基本一致,直到染毒的44 d,64 d才表现出下降,0.1 ng/L 组44 d还呈现显著差异,64 d呈现极显著差异;1 ng/L浓度组雌二醇水平在染毒中期(14 d-44 d)表现为上升,1 ng/L的14 d、26 d和44 d还呈现显著差异,10 ng/L组的上升趋势比1 ng/L的要微弱得多;高浓度组(100 ng/L)染毒2 d就表现为下降,26 d后全程极显著下降。总之,在实验进程中杂色鲍性腺的雌二醇含量除100 ng/L组维持较低水平外,其余浓度组表现出与睾酮相同的先降后升再降的趋势,上升的时间基本集中在14-44 d之间,恢复期20 d各浓度组基本维持在原有水平上。
图3-14 TBT暴露对杂色鲍性腺雌二醇含量影响的时间-效应曲线(84 d为恢复期第20 d)
Fig3-14 Time-effect of estradiol in the gonad of
Haliotis diversicolor exposed to TBT
N=4-6 *表示与对照组比较有显著差异 **表示与对照组比较有极显著差异
从图3-15及可以看出,雌二醇水平在性腺中在染毒前期基本一致,染毒中后期同一采样时间呈现出先降后升再降的变化趋势,低浓度组(0.1 ng/L)的在染毒中后期有些下降;中浓度组雌二醇水平在染毒中期就受到诱导,10 ng/L组的诱导趋势没有1 ng/L强烈;高浓度组(100 ng/L)染毒基本呈现抑制,26 d后全程都是极显著抑制。
图3-16 TBT暴露对杂色鲍血淋巴液雌二醇含量的影响(84 d为恢复期第20 d) N=4
Fig3-16 Effect of TBT exposure on estradiol in the hemolymph of Haliotis diversicolor
从图3-16可以看出,雌二醇在血淋巴液中水平为0.53-1.35 pg/ml之间,在实验进程中除最高浓度组持续下降外,其余表现出先降后升的趋势,上升的时间基本集中在44-64 d之间,恢复期20 d各浓度组继续上升;雌二醇水平在对照及低浓度保持上升,血淋巴液中的雌二醇变化规律与性腺中基本一致,但表现出时滞现象。
3. TBT暴露对雌性杂色鲍性腺睾酮与雌二醇比值的影响
从图3-17可以看出,性腺中睾酮与雌二醇的比值分布在0.13-48.36之间,这一比值随时间和浓度整体呈上升趋势,呈现良好的时间-剂量-效应。在0.1 ng/L浓度组比值呈缓慢上升趋势,包括在恢复期也在上升,但没有显著差异;在1 ng/L和10 ng/L浓度组只有在染毒的后期才表现为上升,两组64 d的比值还表现为显著差异,在恢复期则有所下降;高浓度则表现出显著上升趋势,与对照组相比全程表现为显著差异,44 d和64 d还表现为极显著差异。
图3-17 TBT暴露对杂色鲍性腺睾酮与雌二醇比值的影响(84 d为恢复期第20 d)
Fig3-17 Effect of /TBT exposure on ratio of testosterone to estradiol in the gonad of
Haliotis diversicolor
N=4-6 *表示与对照组比较有显著差异 **表示与对照组比较有极显著差异
综上所述,正常生理状况下的杂色鲍性激素水平会随着繁殖阶段的不同而呈现不同变化,性腺T和E2两种性激素在对照组就呈现先升后降的规律,血淋巴液中E2水平呈现先降后升的变化,但性腺中T/E2的比值基职称论文发表本保持不变。TBT暴露对杂色鲍性腺T含量水平的影响主要体现为中高浓度染毒后期诱导;性腺E2水平低浓度组在染毒末期出现抑制,中浓度组在染毒中期受到诱导,高浓度组全程表现为受到抑制;血淋巴液中E2水平在实验进程中除最高浓度组持续下降外,其余表现出先降后升的趋势;而T/E2比值在低浓度组呈缓慢上升趋势,在中浓度组在染毒的后期表现为上升,在恢复期则有所下降;高浓度则表现为全程上升趋势。
