第一章 文献综述
1 DEAD box 解旋酶家族研究进展
解旋酶是参与核酸代谢的重要酶分子,涉及多种细胞功能。根据主要的分子结构,可分为 6 个超家族(SF1-SF6)[1-2],其中,多数解旋酶属于解旋酶超家族SF1 和 SF2。SF1 和 SF2 解旋酶通常在 DNA 或 RNA 底物上充当单体或二聚体,而大多数 SF3-SF6 解旋酶形成环状的六聚体结构,环绕核酸,主要在 DNA 复制中发挥作用。根据解旋酶发挥作用时的底物种类进行划分,可将解旋酶分成 DNA解旋酶和 RNA 解旋酶。另外,有些解旋酶既可解旋 DNA 也可解旋 RNA [3]。DNA解旋酶部分解开双链 DNA,并参与 DNA 复制、重组和修复以及整体基因组稳定性[4]。与 DNA 解旋酶不同,RNA 解旋酶在 RNA 代谢的全过程均可重塑 RNA 或RNA /蛋白质复合物的结构[5]。大部分 RNA 解旋酶属于 SF2 超家族,SF2 超家族细分为 DExD / H 家族,RecQ 家族和 SWI / SNF 家族。根据相应标志性基序划分,DExD / H 蛋白进一步分为 DEAD、DEAH 和 DExH 家族[6]。DExD / H 家族具有共同的域结构,但功能和机制不同。
DEAD 家族是 DExD / H 蛋白最大的亚家族,家族中的大多数成员依靠水解ATP 的能量区域解开 RNA 双链体。该家族的特征是解旋酶核心的保守基序 Asp-Glu-Ala-Asp(DEAD),因此该家族以 DEAD 命名。家族成员通过将三磷酸腺苷(ATP)水解产生的能量用于结合 RNA 和解旋 RNPase。前者作用于分子间或分子内 RNA 结构的重排,而后者则涉及 RNP 的缔合或解离。在多种生物中的遗传和生化研究表明,DEAD-box 解旋酶对以 RNA 为中心的功能至关重要。对该家族部分成员进行结构分析和分子生物学研究揭示这些保守的蛋白质发挥多样化的功能,包括转录、剪接体组装、核糖体生物合成、mRNA 输出、线粒体基因表达、质量控制 RNA 或 RNP [7-8]、解离 RNA 蛋白质复合物[9]或 RNA 退火[10-12]等。
.......................
2 脑心肌炎病毒研究进展
2.1 脑心肌炎病毒来源
脑心肌炎病毒属于小 RNA 病毒科(Picornaviridae),心病毒属,可感染多种哺乳动物,并且通过破坏 B 细胞而引起的心肌炎、神经系统疾病以及糖尿病 [70-71]。它于 1945 年由 Helwig 和 Schmidt 在佛罗里达州迈阿密市首次分离出来[72]。它是从一只突然死于肺水肿和心肌炎雄性长臂猿中分离得到。将长臂猿滤过的浮肿液接种小鼠,小鼠出现后肢麻痹,心肌炎,随后在一周内死亡。因此将该病原体称为脑心肌炎病毒。1948 年,Dick 等在乌干达恩德培的 Mengo 区分离出Mengo 病毒。它是从后肢麻痹的恒河猴中分离出来的。1949 年,交叉血清中和研究表明,Mengo 和 EMCV 在抗原上彼此相似,这意味着二者是同一物种的一部分,后确定为另一种心脏病毒。脑心肌炎常见毒株有 Mengo 病毒、Columbia-SK 病毒、Maus Elberfield 病毒及小鼠脑脊髓炎病毒 B 型和 D 型等[73-75]。自 2005年首次在国内分离并鉴定了该病毒[76],目前发现它在我国分布广泛[77-79]。对人群进行 EMCV 抗体检测,证实人易感染 EMCV [80],因此认为 EMCV 感染具有潜在的公共卫生学意义。
2.2 脑心肌炎病毒结构
像其他小核糖核酸病毒一样,EMCV 是一种小的无囊膜病毒,构成直径为 30 nm 的二十面体衣壳,基因组由约 7.8 kb 的阳性单链 RNA 组成。基因组含有一个大开放读码框(ORF),可编码 2292 个氨基酸组成的多聚蛋白。该多聚蛋白最终切割成 11 个成熟蛋白,包括结构蛋白 4 个(VP1-VP4)、非结构蛋白 6 个(2A-3D)和前导蛋白 L[81]。结构蛋白组成病毒衣壳并参与病毒抗原表位的形成,其中 VP1 对抗原表位的形成最为重要,它通过不断地产生变异来维持 EMCV 的活性[82-83]。VP2 蛋白具有免疫活性,VP3 不仅与病毒的嗜性相关,而且存在着少量抗原表位,VP4 基因位于病毒结构蛋白内侧,其抗原性最弱。
.......................
第二章 DDX56 蛋白对 EMCV 体外增殖的作用研究
1 材料及仪器设备
1.1 细胞、质粒与病毒
A549 细胞、HEK293T 细胞、BHK-21 细胞、DDX56 siRNA、质粒 pCMV-HA-VP1/VP2/2A/3A、质粒 pCMV-Myc-2C/3C、EMCV 毒株(GenBank:X74312)由西北民族大学生物医学研究中心提供。
1.2 主要试剂
主要试剂
2 方法
2.1 细胞复苏及培养
取出冻存于液氮中的细胞冻存管,拧紧管盖,置入 37℃的温水中快速混匀,震荡至冻存液融化后,950 rpm/min 离心 10min。弃去冻存管中冻存液,加入 1mL对应的含血清的新鲜培养液,使细胞重悬并转移至细胞培养瓶中,补充适量的对应的新鲜培养液后,置于 37℃、5%CO2 条件下培养。待细胞融合度达到 90%时,可进行细胞传代。
细胞传代操作如下:用 75%酒精将装有细胞的培养瓶、含血清的新鲜培养液瓶、胰酶瓶和灭菌过的新培养瓶仔细消毒三遍,然后弃去待传细胞的旧培养基,加入胰酶至刚好没过细胞,观察胰酶对细胞的消化情况。待观察到细胞表面出现针孔状脱落时,弃去胰酶,加入含血清的新鲜培养液终止消化;反复轻柔吹打均匀,取部分细胞悬液至新的细胞培养瓶中,补适量的培养基,拧紧瓶盖,转移至37℃ 5% CO2 条件下培养。细胞融合度达 90%时可进行下一次传代培养。
2.2 宿主细胞感染
EMCV 对 DDX56 的影响 A549 细胞接种于 6 孔板,细胞密度达 90%时, 以 EMCV(MOI= 0.001)接种细胞,病毒体积=细胞数× MOI/0.7 × TCID50[108] 。接毒 2h 后弃去病毒液,换为维持液继续培养,放置于 37℃ 5%CO2 培养箱中继续培养。接毒 0h、4h、8h、12h 和 24h 收集细胞。收集细胞时,每孔使用预冷的 1×PBS 缓冲液润洗两遍细胞后收集细胞,利用 Western blot 检测宿主细胞感染 EMCV 后的内源性 DDX56蛋白表达的变化情况。
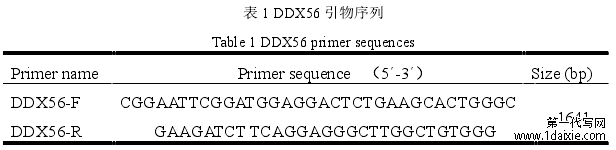
表 1 DDX56 引物序列
..........................
第三章 DDX56 蛋白对 RLRs 信号通路的调控作用研究...................20
1.材料及仪器设备..................20
1.1 主要材料..................20
1.2 主要试剂..................20
第四章 DDX56 抑制 IRF3 入核的机制研究..................30
1 材料及仪器设备................30
1.1 主要材料..................30
1.2 主要试剂..................30
第五章 结论..................40
第四章 DDX56 抑制 IRF3 入核的机制研究
1 材DDX56 蛋白与 MDA5 蛋白、MAVS 蛋白、TBK1 蛋白和 IRF3 蛋白的互作验证
HEK293T 细胞培养至细胞密度为 90%左右时,进行脂质体法转染实验。①一孔转染 2μg pCMV-Myc-DDX56,另一孔转染 2μg pCMV-Myc,转染 4h 后使用含有 250nM poly(I:C) 的细胞维持液 24h 后收集细胞样品;③组用于检测 DDX56与内源性 IRF3 蛋白互作,一孔转染 2μg pCMV-Myc-DDX56,另一孔转染 2μg pCMV-Myc;②组用于检测 IRF3 与内源性 DDX56 蛋白互作,一孔转染 2μg pCMV-Myc-DDX56,另一孔转染 2μg pCMV-Myc,③组用于检测 DDX56 与外源性 IRF3互作,一孔转染 2μg pCMV-Myc 质粒及 1μg pCMV-IRF3(5D)-FLAG 质粒,另一孔转1.2 主要试剂g pCMV-Myc-DDX56 质粒及 1μg pCMV-IRF3(5D)-FLAG 质粒;③组用于检测外源性 IRF3 与 DDX56 互作,一孔转染 1μg pCMV-FLAG 质粒及 2μg pCMV-Myc-DDX56 质粒,另一孔转染 2μg pCMV-Myc-DDX56 质粒及 1μg pCMV-IRF3(5D)-FLAG 质粒;转染 30h 后收集细胞样品,于-80℃冰箱保存备用。Co-IP方法参照第二章 2.10。
........................
第五章 结论
1. DDX56 正调控 EMCV 的体外增殖,并且 DDX56 与病毒非结构蛋白 3C 存在特异性的相互作用。
2. DDX56 与 RLRs 通路中接头蛋白 MDA5、MAVS、TBK1 和 IRF3 均存在特异性的相互作用,并抑制 MDA5、TBK1 和 IRF3 的活化,从而减少 IFNβ 的产生。
3. DDX56 与 IRF3 入核所需的重要转运载体蛋白 KPNA3/KPNA4 存在特异性地相互作用,从而阻止 IRF3 的入核,最终减少 I 型干扰素的产生。
参考文献(略)
