引 言
移植前预处理的目的,一方面是为了最大限度杀灭患者体内的肿瘤细胞,另一方面是为了达到免疫抑制,为供体细胞植入创造条件。安全有效的预处理治疗能降低移植相关死亡(transplantationrelated mortality ,TRM),提高患者无病生存(disease free survival ,DFS),减少复发。近年来,针对高危难治复发恶性血液病设计安全有效的新型的预处理方案一直以来是移植领域研究的热点。复发难治急性髓细胞性白血病(acute myeloid leukemia,AML)及高危骨髓增生异常综合症( myelodysplasia syndrome,MDS)患者,对诱导治疗效果差,或缓解期短,若一味强求完全缓解(complete remission,CR)后再行移植,一方面由于存在耐药可能CR 可能性不大,另一方面,患者的器官累积毒性高,对预处理的耐受性下降,还有部分病例因在化疗过程中出现重症感染,因而影响移植的顺利进行甚至失去移植机会。对于该类患者,需要尽快移植以求得缓解病情,改善生存[1]。然而既往研究表明该类病人进行 allo—HSCT 后,总体生存(overall survival ,OS)仅 20%-30%,因此研究者们尝试通过加入其他化疗药物来增强预处理方案强度,达到降低复发率、减低TRM,改善生存的目的,如伊达比星[2]、噻替哌、足叶乙苷、阿糖胞苷[3]、单克隆抗体等药物被相继用于预处理方案。
地西他滨(5-氮杂-2’-脱氧胞苷酸,de citabine,DAC)在其低浓度时能掺入细胞 DNA,替代肿瘤细胞内胞嘧啶共价结合,导致 DNA 甲基化转移酶(DNA methyl transferase ,DNMT)不可逆失活,重新转录表达由高甲基化引起的沉默基因[4],促进细胞分化和凋亡,抑制细胞增殖;高浓度 DAC 则有细胞毒作用。有研究表明 DAC 能够上调白血病细胞上肿瘤相关抗原,从而对抗肿瘤免疫逃逸,此外还能上调 Treg 水平,因此有望在不影响移植物抗白血病效应(graft versus leukemia,GVL)前提下,降低 GVHD的发生[5,6]。2006 年 5 月,美国食品及药物管理局(Food and Drug Administration ,FDA)批准了 DAC 适用于治疗 MDS。 我国的《骨髓增生异常综合症诊断与治疗专家共识(2012 年)》[7]也指出,表观遗传学修饰药物适用于高危 MDS、低危并发严重血细胞减少、依赖输血患者。已有学者提出在MDS及AML患者进行造血干细胞移植前,使用DAC作为过渡,进行诱导化疗或巩固治疗,称为桥接治疗,以达到降低肿瘤负荷、控制疾病的目的,为寻找供体争取时间[8]。本研究将 DAC 纳入造血干细胞移植预处理方案,使得去甲基化治疗在移植过程中同时发挥作用,利用 DAC 对造血重建的改善,以及不影响 GVL,改善 GVHD 的特性,改善对难治复发 AML 和高危 MDS 患者的移植结果。本研究拟探讨含 DAC 的预处理方案毒性、移植疗效以及生存情况,以明确含 DAC 预处理方案的可行性,有效性和安全性。
……..
材料和方法
1. 研究对象
选择自 2012 年 5 月 1 日至 2014 年 2 月 28 日在苏州大学附属第一医院血液科接受治疗的 21 例髓系恶性血液病患者,男性 15 例(71.4%),女性 6 例(28.6%);中位年龄 41 岁(9-55 岁)。其中 17 例 AML(81%),3 例 MDS(14.3%),1 例 HAL(4.8%);所有患者中伴有染色体复杂异常或 7 号染色体异常或 DNMT3A 突变 10 例(47.6%)。移植前原发病 CR 8 例(38.1%),部分缓解(partial remission,PR)5 例(23.8%),未缓解(non-remission,NR)7 例(33.3%)。所有诊断符合中华医学会血液学分会制定的相关疾病诊疗指南(或共识)标准[9-11],全部病例有明确的外周血常规及细胞分类、骨髓形态、免疫分型、染色体、融合基因、基因突变等检查结果,MDS 病例进行骨髓活检病理检查。21 例患者的临床特征见表 1-1,表 1-2。17 例 AML 患者中 12 例(70.6%)为原发, 其中 4 例(23.5%)继发于 MDS,1例(5.9%)由慢性粒细胞白血病(chronic myelocytic leukemia ,CML)急非淋转化;属于复发/难治 AML11 例(64.7%);根据遗传学预后分组标准,5 例(29.4%)为预后良好,12 例(70.6%)为预后差。AML 患者临床特征见表 1-3。3 例 MDS 患者中难治性血细胞减少伴多系增生异常(refractory cytopenia withmultilineage dysplasia, RCMD)1 例(33.3%),难治性贫血伴原始细胞增多(refractoryanemia with excess blasts,RAEB)-1 型 1 例(33.3%),RAEB-2 型 1 例(33.3%);染色体良好 2 例(66.7%),不良 1 例(33.3%);按 MDS 国际预后分期系统(Definitionof the International Prognostic Scoring System,IPSS),1 例中危-1(33.3%),2 例中危-2(66.6%);按 WHO 分类的预后评分系统(Definition of WHO adapted PrognosticScoring System,WPSS)3 例均为高危组。MDS 患者临床特征见表 1-4。
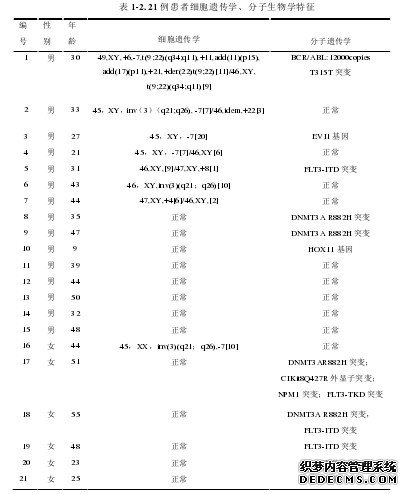
………
2.方法
18 例(85.7%)患者行 DAC 联合改良 BuCy 方案预处理。DAC 20mg/m2/d*5d 核算总量, 分 3-4 天用完。结束+1 天开始联合改良 BuCy 方案:CCNU 250mg/m2/d -10d,Ara-C 2g/m2q12h -10/9d 起*2d,Bu 0.8mg/kg/6h -7/8d 起*3d,Cy 1.8g/m2/d -5/4d起*2d。2 例(9.5%)微移植患者采用 DAC 联合 Ara-C+IDA 方案预处理。DAC 总量100mg/m2,分 3 天应用),结束后给予 Ara-C 1g/m2q12h*4d,IDA 10mg/m2*2d。1 例(4.8%)患者采用 DAC 联合 Ara-C 方案预处理。DAC 总量 100mg/m2,分 3天应用,结束后给予 Ara-C 2g/m2 q12h*2d。21 例患者均接受异基因造血干细胞移植(包含 2 例微移植)。亲缘关系 19 例(90.5%),其中单倍型移植 13 例(57.1%),无关供体 2 例;人类白细胞抗原(humanleukocyte antigen,HLA)全相合 7 例(33.3%),不全相合 14 例(66.7%,1 例为 DQ亚位不全相合)。有 5 例(23.8%)患者接受骨髓来源干细胞,11 例(52.4%)接受外周血来源干细胞,4 例(19%)接受骨髓及外周血来源干细胞,1 例(4.8%)接受骨髓、外周血、脐血来源造血干细胞。供体动员于移植前-4d 开始,应用重组人粒细胞集落刺激因子 300ug q12h 皮下注射。动员第 4、5 天应用血细胞分离机采集外周血干细胞;骨髓干细胞供者于输注当天采集骨髓造血干细胞;脐血来源于上海脐血库。所有干细胞均经外周置入中心静脉导管(peripherally inserted central catheter,PICC) 输入。
……..
材料和方法.....3
1.研究对象......3
2.方法.......6
结 果.........9
1.异基因造血干细胞移植治疗的预后....9
2.不良反应.... 11
讨 论.......14
讨 论
白血病是一组起源于造血干、祖细胞的血液系统恶性疾病。患者出现贫血、出血、感染、器官浸润等临床表现,最终导致死亡[13]。MDS 是起源于造血髓系定向干细胞/多能干细胞的异质性克隆性疾病,有 20%左右的 MDS 将转化为白血病,多数因感染,出血,尤其是颅内出血导致死亡。有 70%的 AML 可以通过诱导化疗取得 CR,但仍有约 20%-30%的初治病人经过 2 个标准诱导方案治疗后病情未得到缓解;并且有一部分已 CR 的病人出现了疾病复发,再次进行诱导治疗的缓解率大大降低。MDS 患者经 IPSS 评分可进行危险分层,并指导治疗。高危组患者预后较差,可参照 AML进行治疗,但 CR 率 40%-60%,并且缓解期较短,老年患者对化疗的耐受性差。进行造血干细胞移植,不仅能利用大剂量化疗预处理方案杀伤白血病细胞,还能通过 GVL效应进一步清除体内白血病细胞,起到根治白血病的目的。在造血干细胞移植过程中,移植前预处理是关系到移植能否成功的重要环节之一。有效的预处理治疗能降低TRM,提高 DFS,减少复发,降低 NRM。理想的预处理方案需要既能有效杀伤肿瘤细胞,具备明显的免疫抑制作用,还要尽可能减少毒性反应。近年来,发现,在 AML 和 MDS 患者中,具有总体 DNA 高甲基化和多种基因沉默并存[14,15]。在 MDS 患者中,甲基化程度越高,进展至急性髓细胞白血病的可能越大,生存期越短。去甲基化药物 DAC(5-氮杂-2’-脱氧胞苷酸)在其低浓度时能掺入细胞DNA,替代肿瘤细胞内胞嘧啶共价结合,导致 DNMT 不可逆失活,重新转录表达由高甲基化引起的沉默基因[4],促进细胞分化和凋亡,抑制细胞增殖;高浓度 DAC 则有细胞毒作用。DAC 对多种恶性血液病包括骨髓增生异常综合症、急性髓细胞白血病和慢性粒细胞自血病等均有明显疗效。
……….
结论
1. allo-HSCT 是治疗复发难治 AML 和高危 MDS 的有效手段。在 allo-HSCT 前使用含有 DAC 的预处理方案是可行的,患者耐受良好,移植相关死亡率仅 4.8%,非复发死亡率仅 9.5%。
2.应用含 DAC 预处理方案的 allo-HSCT,95.2%患者达到 CR,并获得完全植入,造血重建迅速,尤其是巨核系,可能与 DAC 能够促进巨核细胞成熟,加快血小板释放的作用相关;移植后累积复发率 38.7%,预计 2 年 DFS 达 55.3%。aGVHD 累积发生率 28.6%,I-II 级、III 级、IV 级 aGVHD 累积发生率分别为 14.3%、9.5%和 4.8%。该方案可能减少 aGVHD 发生率。
3.对染色体复杂异常、7 号染色体异常和伴有 DNMT3A 突变的高危恶性血液病患者,应用含 DAC 预处理方案,可能具有改善预后和生存的优势;但需要扩大样本进一步研究。
DAC 作为表观遗传学修饰药物代表之一,在 MDS 及 AML 的化疗中已证实其有效性。本研究初步证实 DAC 作为预处理方案用药的安全性和有效性。今后有必要探索预处理中 DAC 的最佳剂量、用法及其他可能的联合用药以提高移植的成功率,降低移植相关死亡率。
…………
参考文献(略)
