本文是一篇医学论文,本研究首次发现了VDAC1在先天性免疫调控中的作用,为该蛋白的相关研究填补了空白,也为研究HEV感染的致病机制提供了重要线索。
第一章 文献综述
1戊型肝炎病毒研究进展
1.1 概述
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus, HEV)引起的人和动物肝脏慢性炎症的一种人畜共患病,主要经粪口途径传播。自从猪HEV被发现,动物传染病的传播风险已经成为一个备受关注的公共卫生问题,大多数急性戊型肝炎感染都与食用被污染的猪肉或猪的肝脏有关。HEV是全球范围内急性病毒性肝炎的主要原因之一,在免疫力低下的患者中发展为慢性感染的风险很高[1]。因此,亚洲、非洲、南美洲等一些经济条件、医疗卫生条件落后的发展中国家都是HEV的高发地区[2]。全球每年有2000万人感染HEV,其中有330万人会出现戊肝症状,高达0.15~1.1亿人最近或正在感染HEV。每年大约导致4.4万人死亡(占病毒性肝炎死亡率的3.3%),而孕妇患者的病死率则高达20%~25%,妊娠期间的孕妇感染后可出现病毒血症而造成流产,目前HEV依旧是世界卫生组织的公共问题[3]。
1.2 HEV基因组
HEV是一种基因组大小为7.2 kb的单股正链RNA病毒,HEV病毒有包膜状和非包膜两种模式[4],从HEV患者的粪便样本中提取的HEV病毒粒子为27 nm~34 nm大小的非包膜形式[5],而从HEV患者的血清中收集到的HEV病毒是包膜形式的[6]。HEV基因组由5’UTR(非编码区),以及三个开放阅读框(Open reading frame,ORF)组成[7],5’端有帽子结构,3’端有多聚腺酸结构。其中ORF1蛋白编码病毒RNA复制所需的复制酶[8],ORF1在不同基因型中存在差异,研究表明ORF1与病毒的感染和致病性相关[9]。ORF2蛋白编码病毒的衣壳蛋白,长度为660个氨基酸,主要的功能为保护病毒基因组的完整性,ORF2同时也参与重要的生理活动,其中包括病毒的装配、侵染以及与宿主互作[10]。
2 VDAC1的研究进展
线粒体作为细胞的能量发电站,不仅是生物合成和生物能源生产场所,还参与调节细胞稳态、新陈代谢、先天免疫反应、细胞凋亡和表观遗传等细胞活动,几乎在细胞生物学的所有方面都发挥着至关重要的作用。以上功能通常以线粒体内外的代谢通路为中心,而位于线粒体外膜的“守门员”-电压依赖性阴离子通道1(Voltage-dependent anion channel 1,VDAC1)负责调节线粒体与细胞其他组份之间的代谢物和能量交互,并在线粒体介导的细胞凋亡中发挥重要作用[41-42]。
VDAC1表达紊乱造成的线粒体功能障碍与多种疾病有关,包括癌症[43]、神经退行性疾病[44-46]、2型糖尿病(T2D)[47]、自身免疫疾病[48]和非酒精性脂肪肝[49]等。此外,VDAC1也参与病毒的感染过程,影响病毒的复制能力[50-51]或调控感染细胞的凋亡[52]。
2.1 VDAC1的结构
哺乳动物的电压依赖性阴离子通道家族(VDAC)有三种亚型(VDAC1、VDAC2和VDAC3),它们具有相似的结构和功能[53]。其中VDAC1是最丰富的亚型;VDAC2的敲除会致死,被认为是一种抗凋亡蛋白;而对有通道蛋白活性的VDAC3的研究最少。VDAC1的氨基酸序列中含有2个半胱氨酸,而VDAC2和VDAC3分别含有9个和6个半胱氨酸,这些半胱氨酸被认为在氧化应激传感器功能中起作用[54]。VDAC1包含19个平行排列的跨膜β折叠(β1~β19)组成的β桶状结构(图1),每个β折叠(约含有10个氨基酸)由柔性环状结构相连接,在线粒体外模上形成的通道孔径约为3.1 nm~3.5 nm。
第二章 HEV ORF2互作蛋白的筛选与鉴定
1实验材料与主要设备
1.1细胞株与质粒
人肝癌细胞(Huh-7和HepG2)、人胚胎肾细胞(HEK-293T)由本实验室保存,HEV Kernow C1/P6(KerORF2)质粒、pCMV-3×Flag、pCMV-HA和pCMV-myc均由西北民族大学生物医学研究中心提供。
1.2主要试剂及仪器
2.实验方法
2.1 转录组学分析慢性HEV的关键Maker蛋白
使用关键词“慢性戊型肝炎感染”在GEO数据库(https://www.ncbi.nlm.nih.gov/gds)中搜索相关的人类微阵列数据,并确定只有一个匹配的数据集(Accession No.GSE36539,GPL6480)来自前瞻性病例对照研究。该转录组数据集包括8个全血样本和8个单核细胞样本,样本分别来自感染或者未感染慢性戊型肝炎(Chronic hepatitis E,CHE)的肾移植患者。其中对照组患者无病毒感染,并根据肾移植后时间、性别、年龄和免疫抑制治疗等因素与CHE患者进行匹配。使用R语言中的limma包(4.1.1版本,http://www.bioconductor.org/packages/release/bioc/html/limma.html)中的normalize BetweenArrays函数对GSE36539基因表达图谱进行归一化,以便进一步分析, 使用语言中的limma包在GSE36539数据集中进行CHE患者与对照组患者的差异表达分析。根据调整后的P值<0.05和t检验鉴定DEGs,此外,Benjamini-Hochberg (BH)方法与阈值|Log(FC)|>1用于校正多次比较。
为了筛选CHE关键的生物标志物采用了四种算法。其中基于DEGs在R语言中进行了三种算法,包括使用random Forest包的随机森林(RF)分析法,使用glmnet包的最小绝对收缩和选择(LASSO)逻辑回归法,以及使用e1071包的支持向量机(SVM-RFE)法,分别对RFE和SVM分类集进行了五次交叉验证。使用R语言中的WGCNA包对GSE36539数据集进行WGCNA分析利以及GO-KEGG富集分析,并用维恩图(Venn diagram)对上述4种分析的重叠基因进行了鉴定并进行了进一步分析。
第三章 VDAC1 调控I型干扰素信号通路的分子机制初探 ............. 36
1 实验材料与主要实验设备........................ 36
1.1 细胞株与质粒 ................................... 36
1.2 主要试剂及仪器 ............................... 36
第四章 全文结论 .......................... 56
第三章 VDAC1调控I型干扰素信号通路的分子机制初探
3 实验结果
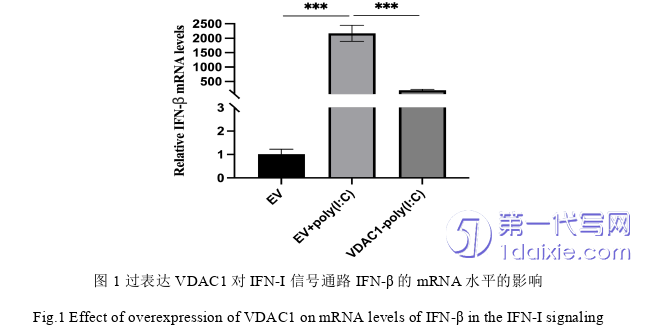
3.1 过表达VDAC1对IFN-I信号通路IFN-β的mRNA水平的影响
在293细胞中过表达VDAC1 24 h后转染Poly(I﹕C)激活剂和不加Poly(I﹕C)激活剂情况下,36h后收集细胞进行RT-qPCR实验。结果表明,过表达VDAC1能够抑制激活剂诱导的IFN-β的表达(图1)。
第四章 全文结论
1、基于转录组分析数据集获得23个差异表达基因,它们主要参与I型干扰素应答、I型干扰素信号途径和病毒应答(丙型肝炎等)、病毒防御应答等生物学过程;然后,结合四种机器-学习算法(RF、LASSO、SVM和WGCNA),筛选获得慢性HEV感染相关的2个关键生物标志基因(VDAC1和BATF2)。
2、以HEV ORF2为诱饵蛋白,筛选人类肝癌细胞(Huh-7)中与之互作的宿主细胞蛋白,获得37个候选蛋白,结合前期结果,选取VDAC1为靶蛋白。经验证发现ORF2与VDAC1存在相互作用和共定位现象,并且随着ORF2表达量升高VDAC1表达水平下调。
3、VDAC1的表达负调控IFN-β的产生;VDAC1过表达会下调MDA5、MAVS、TBK1(及其磷酸化)以及磷酸化的IRF3的表达水平;经筛选发现VDAC1与MAVS、TBK1和IRF3均存在相互作用,揭示了在该信号通路途径中,VDAC1的接头分子为IRF3。
4、VDAC1与IRF3存在共定位现象,并且显著抑制IRF3蛋白的核移位,暗示VDAC1通过与IRF3的结合抑制IRF3入核过程。 综上,本研究首次发现了VDAC1在先天性免疫调控中的作用,为该蛋白的相关研究填补了空白,也为研究HEV感染的致病机制提供了重要线索。
参考文献(略)
