本文是一篇医学论文,本研究探究ADAMDEC1在肿瘤微环境中的作用:肿瘤微环境对肿瘤生长和转移具有重要影响,未来拟探究ADAMDEC1在肿瘤微环境中的作用机制,包括其与肿瘤免疫逃逸、血管生成和肿瘤细胞间相互作用等方面的关系。
第一章 前 言
1.1 结直肠癌的概述
结直肠癌(colorectal cancer, CRC)是确诊率第三高的癌症类型,也是造成癌症相关死亡的三大原因之一[1]。据估计,截至2022年1月1日,美国有超过140万人被诊断患有CRC,预计2023年将有153,020例CRC新病例[2]。虽然大多数诊断发生在65岁及以上的人群中,但19,550例(13%)预计发生在50岁以下的人群中,三分之一将发生在50-64岁的人群中[2]。大约43% 的诊断发生在45-49岁的人群中[3]。此外,到2023年,估计将有52,550例CRC死亡病例,其中包括3750例(7%)50岁以下的患者[2]。据统计,中国2020年CRC新发病例数达55.55万,占全球新发病例的28.76%,CRC死亡病例数达28.62万,占全球的30.60%[4]。
1.1.1 结直肠癌发病率
CRC年总发病率呈下降趋势,从1985年高峰时的每10万人/66.2人下降到2019年的每10万人/35.7人[5]。其中男性的平均年总发病率(每10万人/41.5人)比女性(每10万人/31.2人)高33%[3]。由于改变风险因素的模式,例如减少吸烟和增加非甾体类抗炎药的使用,以及结肠镜筛查使50岁及以上成年人的发病率急剧下降[4]。与老年人CRC发病率下降相反,20-39岁的成年人和40-54岁的成年人的发病率一直在增加。在最近十年中50岁以下人群的CRC发病率每年增加约2%[6]。但是年轻人发病率增加的原因仍然未知,可能与饮食变化、缺乏运动和普遍肥胖有关[7]。
1.2 ADAMDEC1的概述
ADAMDEC1(A disintegrin and metalloproteinase domain-like decysin 1)是一种高度保守的分泌型金属蛋白酶,是ADAM(A Disintegrin And Metalloproteinase)蛋白家族的一员,主要由树突状细胞和巨噬细胞表达[38]。最近研究表明,ADAMDEC1的异常表达可能与自身免疫性疾病和癌症等疾病的发生和发展有关[39-42]。
1.2.1 ADAM家族
ADAM家族是是锚定在细胞表面膜上的I型跨膜蛋白,迄今为止,已发现20多种ADAM[43]。ADAM包括前结构域、锌结合金属蛋白酶结构域和去整合素结构域[44]。大多数ADAM(除ADAM10和ADAM17外)也具有表皮生长因子(EGF)样结构域,毗邻一个富含半胱氨酸的结构域和一个跨膜区域,随后是一个细胞质尾部[44]。据报道,ADAM蛋白具有多种生物学功能,涉及发育、胞外域脱落、细胞黏附、细胞间相互作用、血管内皮细胞功能、炎症、免疫、信号转导、神经退行性疾病和参与癌症进展[45-48]。
研究表明,ADAM家族在多种癌症中均有表达,通过调控信号转导和肿瘤微环境参与癌症发生发展等诸多病理过程[49, 50]。ADAM15可与细胞整合素α5β1相互作用,促进CRC外泌体的结合和摄取,新形成的外泌体与癌症的恶性表型有关[51]。在CRC中ADAM10的过表达通过裂解细胞粘附分子L1(LI-CAM)的的细胞外结构域诱导CRC转移[52]。Park和Kim等报道了TLR4启动的信号激活ADAM10和ADAM17的表达,促进糖酵解和乳酸的产生,从而促进CRC细胞的恶性增殖[53]。ADAM9在胰腺导管腺癌(PDAC)细胞中高表达,并且与晚期癌症分级和脉管系统浸润有关,在PDAC细胞中干扰ADAM9抑制了血管生成和细胞迁移表明ADAM9在PDAC进展中起着关键作用[54]。
第二章ADAMDEC1在结直肠癌中的表达
2.1 材 料 方 法
2.1.1 主要试剂制备
(1)细胞完全培养基的配制:180 mL RPMI-1640/ McCoy's 5A/ DMEM基础培养基,加入20 mL FBS和200 μL青霉素/链霉素后混匀,4 保存。
(2)10×PBS的配制:分别称取2 g KH2PO4、80 g NaCl、2 g KCl和29 g Na2HPO4·12 H2O,加1000 mL ddH2O,高压蒸汽灭菌,4 保存。
(3)0.25% 胰蛋白酶的配制:取0.25 g胰酶和0.02 g EDTA加100 mL 1×PBS,用0.02 μm滤菌器过滤,封口,-20 保存。
(4)0.01 mol/L 柠檬酸钠抗原修复液的配制:取3 g柠檬酸三钠和0.4 g柠檬酸,定容至1000 mL,配制pH为6.0的0.01 mol/L柠檬酸钠抗原修复工作液。
(5)5×电泳缓冲液的配制:分别称取30 g Tris-base 、10 g SDS 、144 g甘氨酸,加1000 mL ddH2O,放置于搅拌器上混匀。
(6)5×转膜缓冲液的配制:分别称取30 g Tris-base,144 g甘氨酸溶解于600 mL 的ddH2O中,使用时稀释为1×转膜缓冲液,加入200 mL的甲醇,放置于搅拌器上混匀。
(7)10×TBS缓冲液的配制:取88 g NaCl、24 g Tris-base,加入1000 mL ddH2O放置于搅拌器上混匀。使用时500 mL的1×TBS,加入500 μl吐温-20,调节pH至7.5左右。
(8)封闭液:称10 g脱脂奶粉加入100 mL的1×TBST放置于搅拌器上混匀,4 保存。
2.2 实验方法
2.2.1临床标本
本研究收集了2020年至2022年在延安市大学附属医院接受CRC根治性手术患者的15对肿瘤和癌旁组织样本。术后病理检查均证实为CRC。延安大学医学院伦理委员会对样本采集给予批准。本研究严格遵守赫尔辛基宣言。本研究经延安大学医学院伦理委员会批准(No.2022060)。
2.2.2 细胞培养
(1)实验所需细胞系
人结直肠癌细胞系(HCT116、SW480、KM12、HT-29、RKO)和人正常结肠上皮细胞(NCM460)由延安大学医学研究实验中心提供。KM12细胞采用DMEM培养基培养,HT-29细胞采用Mc Coy's 5A培养基培养,其余3株细胞株(HCT116、SW480、NCM460、RKO)采用RPMI 1640培养基培养。所有细胞的对应培养基中含10% 胎牛血清和1% 青霉素/链霉素。于37 、5% CO2细胞培养箱培养。
(2)细胞的复苏
1)准备所需物品,提前30 min将培养基置于37 恒温水浴锅中预热,超净工作台用紫外线消毒30 min,使用前用75% 酒精消毒。
2)将细胞从液氮罐中取出,迅速在37 恒温水浴锅摇晃冻存管至细胞融化。
3)用75% 酒精对冻存管表面进行消毒,用移液器将细胞悬液转移至4 mL离心管中,加入约2 mL提前配制好的对应培养基,轻轻混匀。
4)配平后于低速离心机中,800 rpm,离心5 min。
5)将提前配制好的培养液加入培养皿中,离心好的细胞弃上清,加入1 mL培养基重悬细胞,将细胞悬液加入培养皿中混匀,于细胞培养箱(5% CO2,37 )中培养。
第三章 ADAMDEC1对结直肠癌细胞生长转移的影响 ............................................ 23
3.1 材料方法 ............................................... 23
3.1.1 实验试剂 ........................................... 23
3.1.2 实验器材 ............................................... 24
第四章 GSK3β/Wnt/β-catenin信号通路参与ADAMDEC1调节CRC细胞增殖、迁移和EMT ........ 50
4.1 材料方法 ................................. 50
4.1.1 实验试剂 .................................. 50
4.1.2 实验器材 ...................................... 50
第五章 结论与展望 ............................ 66
5.1 结论 ............................................... 66
5.2 展望 ................................... 66
第四章 GSK3β/Wnt/β-catenin信号通路参与ADAMDEC1调节CRC细胞增殖、迁移和EMT
4.2 实验方法
4.2.1 细胞培养及转染
(1)本章节细胞具体分组如下:
1)在HT-29细胞中分为:control+DMSO组、over-ADAMDEC1+DMSO组、over-ADAMDEC1+FH535组和control+FH535组。
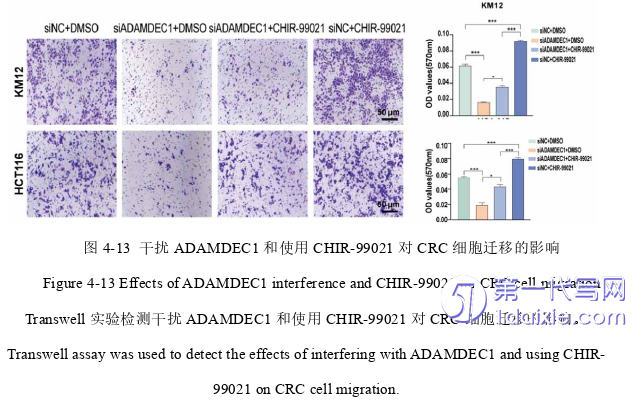
2)在KM12和HCT116细胞中分为:siN C+DMSO组、siA DAMDEC1+DMSO组、si NC+CHIR-99021组和si ADAMDEC1+CHIR-99021组。
(2)细胞培养同2.2.2,细胞转染同3.2.3。
4.2.2 生物信息学分析
利用GEPIA在线数据库分析在CRC中与ADAMDEC1基因表达水平相关性的基因(http://gepia.cancer-pku.cn/)。
4.2.3 Western blot实验
具体步骤2.2.4所述。
第五章 结论与展望
5.1 结论
1.ADAMDEC1在CRC组织及细胞系中高表达,在CRC中扮演着促癌基因的角色;
2. ADAMDEC1促进CRC细胞增殖、迁移、侵袭,抑制细胞凋亡并诱导EMT;
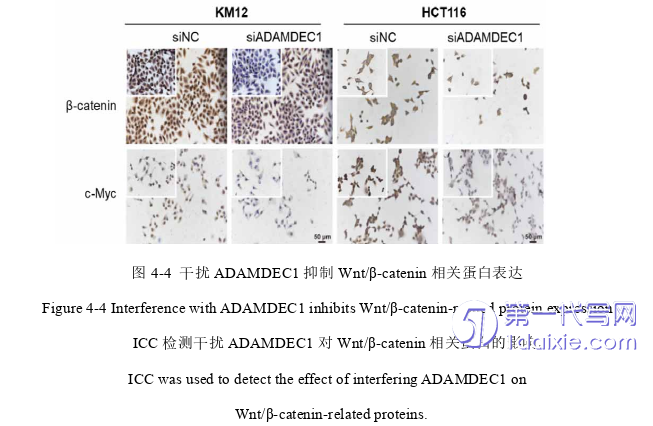
3. ADAMDEC1通过负调控GSK-3β激活Wnt/β-catenin信号通路诱导EMT,促进CRC细胞增殖和转移。
5.2 展望
在本研究中,我们探讨了ADAMDEC1在CRC发生发展中的作用及其作用机制。结果表明ADAMDEC1在CRC中扮演着促癌基因的角色。ADAMDEC1通过负调控GSK-3β激活Wnt/β-catenin信号通路诱导EMT从而促进CRC细胞侵袭迁移及增殖。提示ADAMDEC1在CRC发展过程中的重要作用,这一发现为开发新的治疗策略提供了潜在的目标。 尽管我们已经取得了一些重要的发现,但仍有许多问题需要进一步研究。
进一步验证ADAMDEC1在体内的作用:本研究主要通过体外实验验证了ADAMDEC1的作用机制,未来需要进一步验证其在体内的作用。拟通过建立CRC细胞移植瘤模型,观察ADAMDEC1的表达与肿瘤生长和转移的关系,以及ADAMDEC1的干预对肿瘤生长和转移的影响。
参考文献(略)
