本文是一篇医学论文,本研究主要通过蛋白组学技术探索在WD患者与健康人血浆中的差异蛋白表达谱。再结合生物信息学分析,筛选潜在的WD诊断生物标志物进行ELISA验证,并基于XGboost数据库建立分子诊断模型。
第2章 综述
2.1 肝豆状核变性概述
HLD是一种由ATP7B基因突变所致、以铜代谢紊乱为表现的常染色体隐性遗传病,该基因编码肝细胞内协助铜转运的[13]。 ATP7B基因编码的P型ATP酶位于肝细胞的反式高尔基网络中,负责将铜(Cu)传递给铜蓝蛋白前体合成铜蓝蛋白。在铜超载时,ATP7B将其运输到肝细胞的小管膜和相关的细胞质囊泡隔室,最终通过胆汁排出多余的铜。因此,所有影响ATP7B正常功能的因素(合成的突变、酶的稳定性、在跨高尔基体区域的正确定位以及在细胞内铜过量条件下的运输能力等)均可能导致铜在肝细胞中毒性积累引起肝细胞损伤,继而铜释放到血液中引起全身多器官损害[14]。主要表现为进行性加重的角膜色素环(Kayser-Fleischer ring, K-F环)、神经精神症状、肝脏损害症状等。
1912年Samuel Alexander Kinnier Wilson首次描述了4例“与肝硬化相关的家族性神经疾病”病人[15],总结了该病的典型临床特征,后来该病被命名为威尔逊病(Wilson's Disease,WD)。发现后不到 50 年,WD 成为第一个可接受特定治疗的慢性遗传性疾病,这使得减缓疾病的破坏性进展并防止最终死亡成为可能。尽管取得了这些初步进展,目前的诊断方法仍有局限性,有必要寻找能够对疾病早期具有诊断意义的生物标志物。故而拟从WD血浆蛋白质组学方面着手,进一步发掘蛋白质组学规律及潜在的差异表达蛋白,同时利用生物信息学技术构建分子诊断分类器,为疾病的早期诊断提供依据。
2.2 病因和流行病学
WD是一种单基因遗传病,1984年,Scheinberg和Sternlieb估算WD的患病率为1:30000,杂合携带者频率为1/ 90。然而,这些数据早于ATP7B基因的发现,2013年一项研究表明WD的患病率为1:7000[16]。近年来,大量流行病学研究报告提示WD在不同人群中的患病率不断上升,人们逐渐认识到大量WD患者因缺乏典型临床表现、临床症状多样、发病年龄跨度较大、诊断标准不完善而导致误诊、漏诊等严重后果[16, 17]。据估计,中国该病的患病率高于西方国家,Hu等人在2014年的调查中推断出WD患病率为5.87/100,000[18, 19]。该研究中病例的诊断均基于临床特征、生化参数和 K-F 环的存在。鉴于部分患者无K-F环及其他常见生化异常,以及技术限制的影响,实际患病率很可能被低估。1993年发现该病致病基因是位于常染色体13q14.3位点的ATP7B基因,含有20个内含子和21个外显子。近年来分子诊断的应用越来越广泛,基因序列分析成为鉴定ATP7B突变相对准确的方式。目前已发现的ATP7B基因突变已多达995种,包括缺失、插入和取代,分布在整个编码区以及启动子和内含子区,可能影响ATP7B基因产物的功能和/或表达[20, 21],进而引起肝细胞中的铜不能正常通过胆汁排泄。欧洲和北美最常见的突变类型是His1069Glu (H1069Q);韩国、日本和中国最常见的突变类型是 Arg778Leu;冰岛、西班牙最常见的突变类型分别是 2007del7、Met645Arg。目前突变形式与表型的关系一直未有定论,即使是同一家系患者且具有相同的突变形式,其发病的年龄、临床表现及病情的轻重却有很大不同。WD发病是否还存在其他影响因素、是否存在其他相关基因有待进一步研究。
第3章 材料与方法
3.1 研究对象
本研究收集2017年9月至2020年9月吉林大学第一医院住院和门诊确诊WD患者,患者组及对照组均符合以下纳入/排除标准。
WD组纳入标准:
(1)符合2012年欧洲肝病学会的临床指南,即:1)不明原因肝病病史和(或)神经精神症状;2)铜蓝蛋白水平降低<0.2g/L; 3) 24h尿铜>1.6 mmol/24h ;4)眼部K-F环;5)头部MRI异常;6)肝铜>250 mg/g干重;7)具有ATP7B基因突变位点;8)家族病史。诊断流程按表3.1和图3.1执行。
(2)知情并同意参加本研究,并签署知情同意书。
WD组排除标准:
1)合并乙型或丙型病毒性肝炎、药物性肝炎、酒精性肝病、自身免疫性肝病、重叠综合征、血色病。
2)原患或现患恶性肿瘤。妊娠或哺乳期女性。
WD组分组标准:
(1)肝型:①持续性血清转氨酶增高;②急性或慢性肝炎;③肝硬化;④暴发性肝功能衰竭
(2)脑型:①帕金森综合征;②运动障碍:扭转痉挛、手足徐动、舞蹈症状、步态异常、共济失调等;③肌张力障碍:流涎、讲话困难、声音低沉、吞咽障碍等;④精神症状。
3.2 实验方法
3.2.1 实验试剂

本研究从吉林大学第一医院门诊和住院系统中查找2017-2021年诊断为WD的36名患者(20名WD患者样本作为发现集进行蛋白质组学分析且进行ELISA测试作为训练集,其他16名WD患者作为验证集进行ELISA测试),按纳入标准及排除标准进行筛选、电话随访、采集病史,对签署知情同意书的患者使用6mL的EDTA抗凝管采集清晨空腹血样。 应用同样方法于吉林大学第一医院体检中心采集36名年龄和性别匹配的健康受试者(10个对照组作为发现集进行蛋白质组学分析,其中9个作为训练集进行ELISA测试,另外16个对照组作为验证集进行ELISA测试) 的血样。本研究获得吉林大学第一医院伦理学委员会批准。在获得所有受试者的知情同意后,或者在受试者未满18岁的情况下,从父母和/或法定监护人那里获得知情同意后,对临床记录和血浆进行了测试和分析。将血液样品在2小时内以4000rpm离心5分钟。然后,将上部血浆移液到生物安全柜中的1.5mL EP管中,并将其储存在-80°C冰箱中。接下来,将剩余的血细胞与抗凝管一起高压灭菌并丢弃。
第3章 材料与方法 ................................. 16
3.1 研究对象 ........................... 16
3.2 实验方法 ...................................... 18
第4章 结果................................... 24
4.1 研究对象基本情况 ..................................... 24
4.2 质谱分析及搜库过滤后的肽段和蛋白数总体情况 ................... 26
第5章 讨论................................ 36
5.1 差异表达蛋白 ............................. 36
5.2 肝豆状核变性血浆蛋白生物标志物筛选及诊断模型建立 ....... 39
第5章 讨论
5.1 差异表达蛋白
本研究利用一个发现集通过基于质谱的蛋白质组学方法确定了WD患者血浆样本与健康对照组之间差异丰度高的蛋白质。在此基础上建立了分子诊断模型, 并在ELISA独立血浆样本中进行了验证。近年来,越来越多的研究通过基因组学和代谢组学来了解WD的发病机制或识别生物标志物。截止2020年,人类基因数据库(www.hgmd.cf.ac.uk) 已免费公开了877个基因突变位点,其中794个对WD有明确的致病作用。据报道,WD患者与健康受试者之间存在差异显著的代谢物,且脂质生物标志物对WD具有良好的诊断性能。亦有少数研究利用蛋白质组学技术发现WD患者与健康对照者之间存在差异表达蛋白,但主要集中在动物实验,且均未对生物标志物进行验证[11, 12]。据我们所知,我们的研究首次证明了质谱蛋白质组学与生物信息学分析相结合可以发现WD患者潜在的生物标志物。
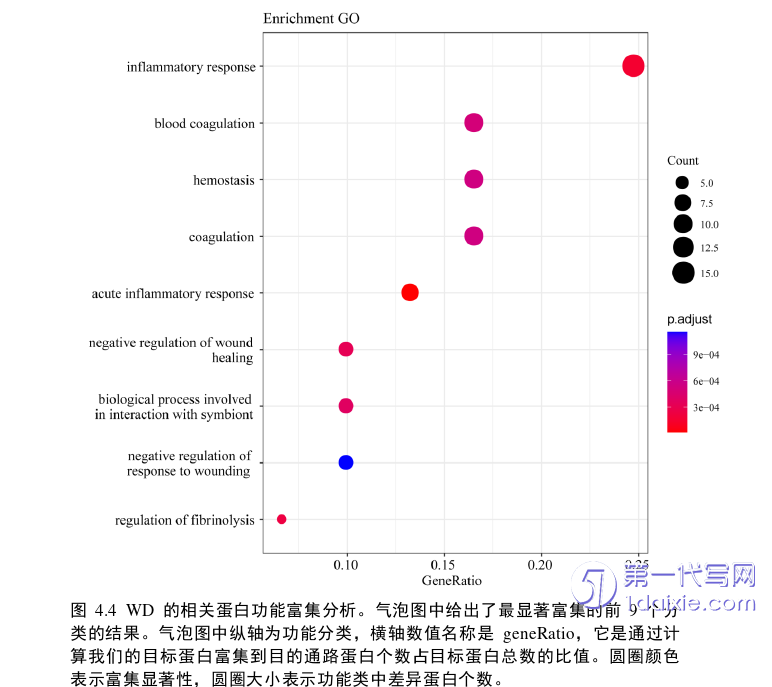
本研究成功在WD患者和健康对照之间的血浆中发现了DEPs,这种改变可能是由于WD病理过程导致的释放或消耗。在肝型WD和脑型WD之间共有62个DEPs,其中差异上调的蛋白18个,差异下调的蛋白44个,这些DEPs可能在不同组织和器官之间的交流中发挥潜在的生理或病理作用。根据GO功能富集分析,这62个DEPs主要参与炎症反应、伤口愈合和凝血级联等生物学过程(图4.4)。
第6章 结论
1、WD患者和健康对照者之间的血浆蛋白质组存在显著差异。受影响的生物过程主要是炎症反应、补体和凝血级联。
2、由F9和C4BPB构成的分子诊断模型对于诊断WD具有较好的预测效能。
参考文献(略)
