本文是一篇医学论文,本研究将三种具有不同微纳米表面结构的BCP、BCPw、BCPw-NPs材料与BMSCs共培养,具有丰富微纳米孔隙结构的BCPw-NPs显示出了比BCP和BCPw材料更强的促进BMSCs向成骨细胞分化的能力。
1 材料与方法
1.2 主要实验仪器设备

1.5 实验方法
1.5.1 不同多孔磷酸钙陶瓷的制备与表征
(1) 普通双相磷酸钙(BCP)陶瓷的准备
多孔BCP陶瓷购买自四川拜阿蒙生物活性材料有限责任公司(规格:TH/φ12×2 mm)。BCP准备:a.取数片BCP放入烧杯中,经去离子水浸泡半小时后超声反复清洗3次,每次10 min,b.将清洗后的BCP转移到10 cm玻璃皿内,放入60 ℃鼓风干燥箱内烘干备用。
(2) 晶须增强型双相磷酸钙(BCPw)陶瓷的制备
BCPw制备:a.取数片清洗烘干后的BCP放于烧杯中,加入适量的去离子水,再将烧杯放入真空干燥箱内真空处理10 min,以便排出材料内的气体;b.真空处理结束后,使用去离子水超声清洗2次,每次5 min;c.将浸泡清洗过的BCP放入反应釜内,加入适量pH =4的去离子水,拧紧反应釜盖子,将其放置在150 ℃干燥箱内反应4 h;d.反应结束后,烘箱温度下降至安全温度时取出反应釜内产物,使用去离子水超声清洗3次,每次5 min,随后放入60 ℃鼓风干燥箱内烘干备用。
(3) 纳米颗粒复合晶须增强型双相磷酸钙(BCPw-NPs)陶瓷的制备
NPs制备:a.向250 mL烧瓶内加入80 mL 0.25 mol/L的 Ca(NO3)2·4H2O溶液,启动磁力搅拌器以800 rpm/min匀速搅拌;b.向烧瓶滴加氨水调节至pH=10.0左右;c.向烧瓶内滴加50 mL 0.25 mol/L (NH4)2HPO4溶液(反应过程中滴加氨水维持反应环境至pH=10.0左右),之后磁力搅拌30 min充分反应;d.搅拌结束后盖好瓶塞,于室温静置36 h进行陈化;e.陈化结束后,弃去烧瓶内的上清液,将沉淀转移至烧杯内,向烧杯内加入适量去离子水,超声洗涤10 min;f.将匀浆转移至50 mL离心管,于4000 rpm/min离心5 min,弃去上清;g.重复e~f步骤洗涤5次;h.将沉淀倒入250 mL烧杯内,加入150 mL 去离子水,超声15 min得到NPs匀浆;i.定量,使用电子天平称量蒸发皿净重(记为m0),向蒸发皿中加入10 mL NPs匀浆烘干后称量(记为m1),计算得NPs浓度(mg/mL)=(m1-m0)/10;j.使用去离子水将NPs匀浆浓度调整为10 mg/mL,用保鲜膜封口烧杯并做好相应标记后放入4 ℃冰箱保存备用。
2 结果
2.1 多孔磷酸钙陶瓷的材料学表征
2.1.1 BCP的结构表征
对BCP进行清洗和烘干处理后,使用扫描电子显微镜(Scanning electron microscope, SEM)观察其宏观形貌和微观结构。结果显示,放大50 X后可以观察到BCP表面存在大量孔隙结构,孔的直径大小不一,约在100~500 m之间,不同尺寸的孔随机分布,部分大孔内壁上有更小尺寸的孔,孔间贯通(图3a);进一步放大后可以观察到BCP孔壁较平坦,由许多粒径约在2 μm左右的不规则晶粒紧密堆叠而成,晶粒与晶粒之间存在1 μm左右的空隙(图3b~图3d)。

2.2 BMSCs分离培养与鉴定
2.2.1 细胞形态鉴定
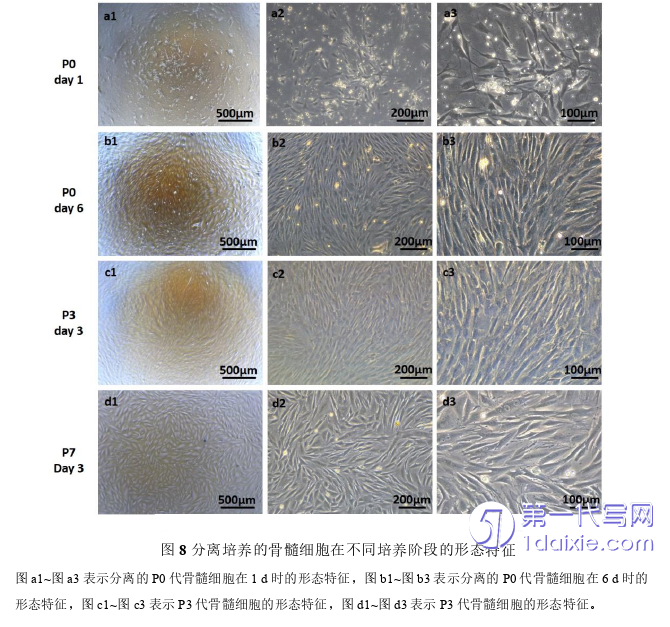
分离新生新西兰兔股骨、肱骨、胫骨骨髓腔内的原代细胞进行培养,在培养过程中使用倒置光学显微镜观察细胞的形态特征和生长情况。在培养24 h时进行首次换液处理,此时显微镜下观察到贴壁的细胞数量比较少,呈现卵圆形、长梭形和多角形等不规则形状(图8a1~图8a3);培养5-6天后细胞铺满板底,大部分呈长梭形漩涡状密集生长(图8b1~图8b3);经过2-3次传代处理后细胞形态单一,形态呈长梭形漩涡状生长(图8c1~图8c3);细胞培养至P7代时细胞形态未发生明显变化图(图8d1~图8d3)。结果显示,分离培养的骨髓细胞具有较稳定的生长和形态特征,符合BMSCs的生长和形态特征。
结果………………………………27
讨论……………………………41
结论…………………………46
3 讨论
近年来由于人口老年化、外伤、疾病等原因造成的骨质疏松、骨缺损患者数量呈逐年上升的趋势,并且在经过治疗后仍有5%的患者发生骨不愈合、骨不连的情况,这不仅严重影响患者的生活质量和生命健康,还给社会带来了巨大的经济压力[46-48]。自体骨移植是骨缺损治疗的金标准,但是随之而来的负面影响也限制了其在临床上的发展和应用[8]。自2007 年到 2017 年间,我国自体骨的临床使用比例由约 81%下降到约 62%,美国自体骨的临床使用比例由约 67%下降到约46%,均呈现逐渐下降的趋势[49],这说明传统的骨缺损治疗方法已经不能满足现阶段的临床需求,迫切的临床需求也显著促进了各种人工骨修复材料的发展。
BCP在结构和生化组成成分上都比较接近天然骨组织的特征,是现阶段比较理想的人工骨替代材料并且已经被应用于临床治疗骨缺损,然而其生物相容性和成骨诱导性仍有待进一步优化和增强[23]。已有研究表明,增加生物材料表面粗糙程度有利于BMSCs的贴附生长和向成骨细胞分化[50],因此在本实验中,将多孔BCP作为陶瓷基体进行水热晶须化[41,51]和NPs灌注[52,53]处理制备出BCPw与BCPw-NPs,期望生成的HA晶须和磷酸钙NPs可以增加材料表面粗糙程度,同时能提升材料内部的微纳米孔隙结构以及孔隙率,达到增强其生物相容性和骨诱导能力的作用。
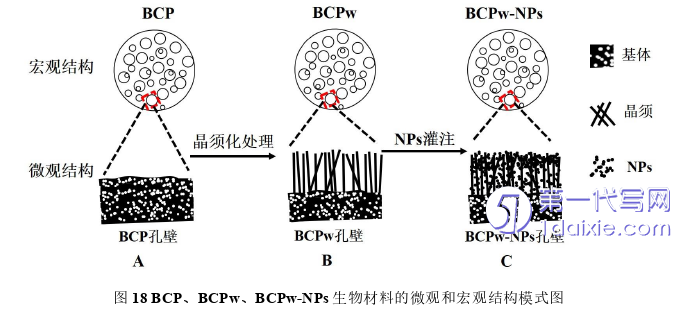
4 结论
在本研究中,以BCP为陶瓷基体,成功设计并改性制备出了具有微晶须表面结构的BCPw和具有微纳米孔隙表面结构的BCPw-NPs。晶须和NPS的引入使普通BCP材料的表面形成了微纳米结构层,带来了丰富的微纳米孔隙,提高了材料的孔隙率。随后将三种具有不同微纳米表面结构的BCP、BCPw、BCPw-NPs材料与BMSCs共培养,具有丰富微纳米孔隙结构的BCPw-NPs显示出了比BCP和BCPw材料更强的促进BMSCs向成骨细胞分化的能力。
