本文是一篇医学论文,笔者经过研究,得出结论:LMO2蛋白在OSCC中的表达水平低于口腔正常组织,可通过检测标本中LMO2蛋白的表达量来鉴别OSCC和口腔正常组织。
第一章前言
1.1 LMO2蛋白
LMO2基因的主要产物是一个具有158个氨基同时串联两个LIM结构域的酸性蛋白[1]。LMO2蛋白属于锌指结构域转录调控因子,能与GATA1、E47、TAL1和Ldb1等转录因子结合形成复合体,识别DNA上相邻的GATA和E-box序列,对下游基因的转录起到调控作用[2]。人类蛋白质图谱的公开数据显示,已检测到LMO2蛋白在甲状腺、唾液腺、食管、胃、直肠、胰腺、前列腺等组织中表达,而目前尚无研究验证LMO2蛋白在口腔组织中的表达情况[3]。
早期的研究认为LMO2是胚胎造血和血管生成的关键调节因子以及急性T淋巴细胞白血病的致癌因子[4-6]。近年来逐渐有研究发现,LMO2在造血系统外的组织中以及一些实体瘤中也广泛表达,并且可能发挥抑癌作用。
在Nakata的研究中,LMO2蛋白在高分化和中分化胰腺癌中的表达显著高于低分化胰腺癌,同时LMO2高表达的患者预后好于LMO2低表达的患者[7]。Liu的研究显示,LMO2在乳腺癌和结直肠癌中的表达显著低于其周围正常组织,同时LMO2在乳腺癌和结直肠癌中可作为肿瘤的抑制因子[8]。由此可见,LMO2蛋白的功能及其对预后的影响在不同的肿瘤中可能不同。本研究第一部分的结果表明LMO2基因在OSCC中表达低于口腔正常组织,LMO2可作为OSCC的保护因子预测患者的预后情况,然而目前尚未有研究验证LMO2蛋白在OSCC中的表达情况。
1.2腮腺PSCC
在头颈部鳞状细胞癌中,OSCC最为常见,而腮腺PSCC极为罕见,世界卫生组织(World Health Organization,WHO)将腮腺PSCC定义为由表皮样细胞构成的原发性恶性上皮性肿瘤,并强调诊断时要严格排除转移癌的可能,同时认为大多数已发表的病例很可能是其他腮腺恶性肿瘤的鳞状分化或转移癌[9]。多年来有关腮腺PSCC的研究普遍认为腮腺PSCC的病理学表现与其他头颈部鳞状细胞癌并没有明显区别,均以异常分化的具有侵袭性的鳞状细胞为主[10,11]。
腮腺PSCC罕见且无特异性临床症状,临床医师在首诊时易忽视腮腺PSCC的可能性,从而造成误诊。腮腺PSCC的诊断没有通用的国际标准,该病的诊断主要依靠病理诊断及临床检查排除转移癌的情况。由于该病没有特异性的临床表现,因此在临床诊疗中术前仅能考虑其为腮腺恶性肿瘤,待手术后,结合术中所见、术中快速冰冻检查结果及术后石蜡切片病理结果确诊为腮腺鳞状细胞癌后,再排除转移癌的情况方能确诊[12]。
关于腮腺PSCC的临床研究较少,目前没有标准的治疗指南,通常是由主刀医师根据经验和腮腺恶性肿瘤的诊疗原则进行治疗,治疗方法主要包括手术切除、颈淋巴清扫、面神经修复、局部组织缺损修复以及术后放化疗等。由于腮腺PSCC具有病程短、进展快的特点,患者确诊时大多为中晚期,而该疾病中晚期预后较差,复发和转移很常见[13]。
第二章材料与方法
2.1实验材料
2.1.1口腔鳞状细胞癌及口腔正常组织切片
收集2018年1月~2022年5月吉林大学口腔医院口腔颌面外科住院治疗的OSCC病例44例,纳入标准:1.病理诊断为口腔鳞状细胞癌;2.口腔原发且术前未接受放化疗者;3.患者信息完整者。另取10例口腔正常组织标本作为对照。所有研究方案均经吉林大学口腔医院伦理委员会批准(2022年35号)。
2.1.2腮腺原发性鳞状细胞癌及腮腺正常组织切片
收集2016年1月~2022年5月吉林大学口腔医院口腔颌面外科住院治疗的腮腺PSCC病例5例,纳入标准:1.病理诊断为腮腺原发性鳞状细胞癌;2.术前未接受放化疗者;3.患者信息完整者。另取10例腮腺正常组织标本作为对照。所有研究方案均经吉林大学口腔医院伦理委员会批准(2022年35号)。
2.1.3主要实验试剂及设备
LMO2兔抗人多克隆抗体A1903(武汉爱博泰克公司)二步法通用试剂盒PV-6000(北京中杉金桥生物技术有限公司)DAB显色试剂盒ZLI-9018(北京中杉金桥生物技术有限公司)PBS缓冲液粉末ZLI-9061(北京中杉金桥生物技术有限公司)EDTA抗原修复液pH9.0 ZLI-9069(北京中杉金桥生物技术有限公司)10%中性甲醛(南昌雨露实验器材公司)冰箱(浙江华日实业投资公司)恒温水浴锅(上海精宏实验设备有限公司)包埋机(德国LEICA公司EG1160)石蜡切片机(德国LEICA公司RM2145)鼓风烤箱(上海一恒科学仪器有限公司DHG-9053A)摄像显微镜(日本OLYMPUS公司BX35)纯水系统(上海和泰仪器有限公司Medium series)磁力搅拌器(德国IKA公司C-MAG HS7)微量移液器(德国EPPENDORF公司Research plus)湿盒(南京初铭实验器材有限公司20片黑色湿盒)
2.2实验方法
2.2.1免疫组织化学染色验证LMO2蛋白的表达
(1)切片及烤片:使用切片机切取各标本,将得到的切片置于60°C烤箱中1h;
(2)脱蜡与复水:将切片置于二甲苯Ⅰ、Ⅱ溶液中各10min,随后置入梯度浓度乙醇(100%、90%、80%、70%)中各5min,最后流水冲洗3min;
(3)标本的抗原修复:将切片置于EDTA抗原修复液(pH9.0)中浸泡,随后置入恒温水浴锅(95℃)中修复15min,待冷却后,PBS缓冲液冲洗3次,每次3min;
(4)滴加适量内源性过氧化物酶阻断剂,孵育10min后,PBS缓冲液冲洗3次,每次3min;
(5)根据组织大小,滴加适量一抗(LMO2,1:100),4℃孵育12h,复温20min后,PBS缓冲液冲洗3次,每次3min;
(6)滴加适量二抗,室温孵育20min,PBS缓冲液冲洗3次,每次3min;
(7)滴加适量DAB显色液,室温孵育3min,自来水冲洗;
(8)复染:苏木素孵育30s,分化,冲洗返蓝;
(9)脱水、透明、封片;
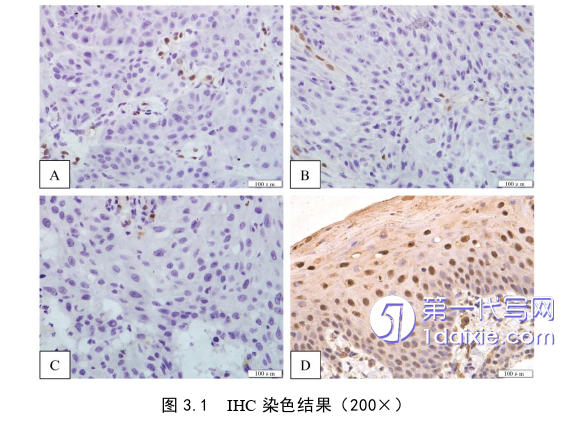
(10)将切片置于显微镜下,使用显微图像采集系统在400×视野下随机选择5个区域拍摄,使用Image Pro Plus 6.0软件计算各图片中的平均光密度值(MeanDensity,MD),5张图片的MD平均值计为该标本的MD值[15]。以MD值表示每个标本中LMO2蛋白的相对表达量。
第三章结果....................................41
第四章讨论.................................44
第五章结论............................46
第四章讨论
本研究首次证实LMO2蛋白在OSCC中的表达量显著低于口腔正常组织,提示其可能参与OSCC的发生发展过程,该结果从蛋白水平验证了本研究第一部分的结果。
本研究对LMO2蛋白在不同临床病理特征患者中的表达水平进行了分析,结果显示,LMO2的表达水平与患者的酗酒史、临床分期和病理分级相关。酗酒患者的LMO2表达水平低于不酗酒的患者。酒精是世界卫生组织认定的一级致癌物,其代谢产物乙醛可作用于正常细胞,使细胞出现DNA单链断裂、突变及染色体畸变等基因异常现象,这一过程可促进细胞癌变[18]。因此作者猜想长期摄入酒精可能改变患者口腔组织内LMO2的表达模式,使LMO2表达降低。
上文结果显示,临床Ⅲ、Ⅳ期患者的LMO2表达水平低于Ⅰ、Ⅱ期的患者,中、低分化OSCC患者的LMO2表达水平低于高分化的患者,这与Nakata在胰腺癌研究中得到的结果相似[7]。临床分期是OSCC治疗和预后评估的重要因素,随着临床分期增高,手术范围往往需要随之扩大并且术后可能需要添加更多辅助治疗方案,同时术后转移及复发的风险也随之增高[19]。病理分级是影响OSCC预后的独立因素,OSCC的分化程度越低,其恶性程度越高,侵袭性越强,其总体生存预后越差[20]。在本研究第一部分中,已在数据库中证实LMO2为OSCC患者预后的保护因子,LMO2高表达者的总体生存期更长。因此作者猜想LMO2可能参与肿瘤的发生发展过程,影响肿瘤的增殖、转移和分化,从而影响肿瘤的预后。
第五章结论
1.LMO2蛋白在OSCC中的表达水平低于口腔正常组织,可通过检测标本中LMO2蛋白的表达量来鉴别OSCC和口腔正常组织。
2.LMO2蛋白的表达水平与OSCC患者的酗酒史、临床分期和病理分级相关,可能对OSCC患者的预后提供一些指导。
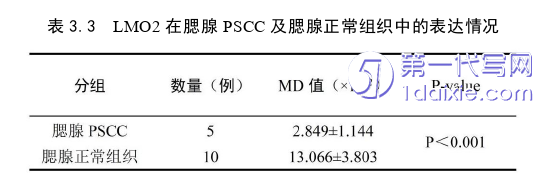
3.LMO2在腮腺PSCC中的表达水平低于腮腺正常组织,可通过检测标本中LMO2蛋白的表达量来鉴别腮腺PSCC和腮腺正常组织。
参考文献(略)
