本文是一篇医学论文,笔者经过研究,得出结论:槲皮素具有抗ETEC-O139诱导的IPEC-J2细胞的炎性损伤作用,这种抗炎作用是通过抑制细菌黏附和调节TLR4/NF-κB信号通路实现的。
第一章产肠毒素大肠杆菌研究进展
1.1产肠毒素大肠杆菌的毒素
ETEC是革兰氏阴性菌的直杆菌,属于肠杆菌科(Enterobacteriaceae)埃希菌属(Escherichia),其抗原主要包括菌体抗原(O抗原)、表面抗原(K抗原)和鞭毛抗原(H抗原)[17]。在ETEC致病过程,发挥致病作用的主要是黏附素和肠毒素。ETEC的黏附素有两类,包括菌毛黏附素和非菌毛黏附素。猪源性的菌毛黏附素主要有F4(K88)、F5(K99)、F18、F41和1型菌毛等,而非菌毛黏附素主要有AIDA-I、Paa、EAE、Tia和TibA等[18]。肠毒素包括耐热肠毒素(heat-stable enterotoxin,ST)和不耐热肠毒素(heat-labile enterotoxin,LT),肠毒素主要是通过破坏肠细胞水和电解质平衡导致腹泻[19]。Ge[20]等研究发现在仔猪感染过程中,几种肠毒素通常是共同产生并协同作用。ETEC在感染过程中对动物有选择倾向性,尤其是倾向于仔猪、新生牛犊和新生羔羊等动物,对于家禽和马的感染并不常见[21,22]。在仔猪腹泻过程,初生仔猪感染一般是由已经感染却未出现腹泻症状的母猪携带病原造成的,尤其是在仔猪出生的早期和断奶后感染几率更高。由于初生仔猪胃和小肠的内部环境偏碱性,碱性条件不利于胃肠道消化酶的产生,但有利于大肠杆菌感染。仔猪出生后3-5天出现腹泻,ETEC通常是主要传染源,且有可能是唯一传染源。仔猪腹泻一般发生在断奶后1-2周内,这段时间感染ETEC会造成断奶仔猪腹泻、脱水,甚至是死亡[23,24]。当ETEC在感染羔羊和犊牛时,二者体内一般只产生STa和菌毛黏附素F5和F41。在犊牛出生后前4天,更容易感染ETEC发生腹泻,导致犊牛死亡率上升[22,25]。
1.2致病机理
肠道是机体重要的器官,负责对机体摄入的营养物质消化和吸收,为机体提供营养物质。肠道有黏膜组织和黏膜相关淋巴组织,因此也构成了机体重要的免疫器官,在调节机体免疫方面发挥关键作用[85]。肠上皮细胞(intestinal epithelial cells,IECs)是肠道主要功能细胞,具有丰富的生物学功能,主要表现在防止肠道中的微生物和有害物质进入机体、维持肠道微环境的稳态、对病原菌和肠道共栖菌的识别作用以及影响抗原递呈细胞和免疫细胞功能等方面[86]。肠道形成了机体重要的屏障,其中包含多种屏障,不同屏障发挥不同的功能,机械屏障主要由黏膜上皮细胞和菌膜等构成,在所有屏障中,机械屏障是所有屏障的基础,其他屏障发挥功能一定程度上依赖于机械屏障。免疫屏障是由肠黏膜和淋巴组织构成,化学屏障主要由黏膜分泌黏液和消化液等构成,生物屏障主要是由正常的肠道寄生菌构成,可以对外来菌发挥抗定植作用。各个屏障协同作用,维持机体内环境稳态[87,88]。
肠道免疫对机体健康起重要作用,肠上皮和淋巴组织构成了肠道免疫屏障,在先天免疫系统发挥重要作用,是机体第一道屏障[89]。肠上皮细胞通过模式识别受体和细胞因子实现免疫调节作用,主要的模式识别受体是来自Toll样受体(Toll-like receptor,TLR)家族和NOD样受体(NOD-like receptor,NLR)家族[90,91]。Toll样受体是胞外主要模式识别受体,可以识别抗原、病原菌和微生物等[92]。TLR2是Toll样受体家族关键成员之一,TLR2识别的微生物种类最多,而且TLR2可以单独和协同家族其他成员发挥识别配体作用,如TLR1或TLR6,它们都可以和TLR2结合形成聚合体,受体结构发生变化,所发挥的识别功能也增强,能识别更多配体[93]。TLR4可以识别细菌、病毒和衣原体等多种微生物。此外,TLR4可以和细胞壁成分脂多糖(lipopolysaccharide,LPS)发生特异性结合,是LPS的主要受体,在识别过程需要髓样分化蛋白的参与[94,95]。NOD样受体(NOD-like receptor,NLR)是一种与TLR相似的模式识别受体,主要在胞内发挥识别作用,NOD1和NOD2是NLR家族的主要典型受体,NOD1维持肠道稳态方面发挥一定作用,NOD2有助于控制肠道共生菌群[96,97]。
第二章槲皮素概述
2.1槲皮素结构特性
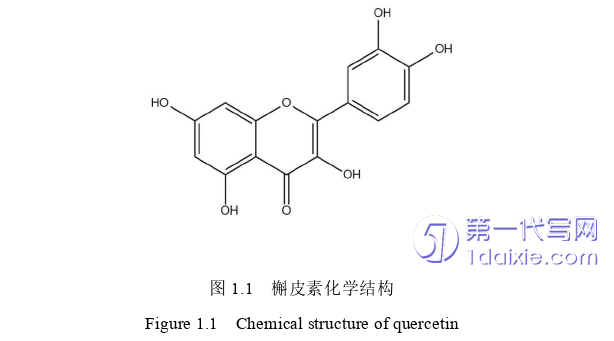
槲皮素(Quercetin,CAS:117-39-5)是一种黄酮类化合物,别名也称栎精、槲皮黄素和槲黄酮等。化学式为C15H10O7,相对分子质量为302.236,眼观是一种黄色针状结晶性粉末,熔点314℃,易溶于甲醇、冰醋酸和吡啶等有机溶剂,不溶于水、乙醚、氯仿和苯[136]。结构如图1.1。
2.2槲皮素的药物代谢动力学研究进展
自20世纪90年代开始,槲皮素的临床作用备受关注,进而出现药代动力学研究,研究人员采用液相色谱-质谱、高效液相色谱和紫外分光光度法等多种分析方法研究槲皮素的药代动力学。
赵[137]等人研究发现静脉注射的槲皮素以原型和代谢物形式排出,主要经过肾脏和胆汁排泄,给药3 h后,检测两种排泄物中槲皮素所占比例达50%左右,说明药物在体内可以迅速代谢。杜[138]等发现灌胃给槲皮素的大鼠的小肠吸收比较快,给药15 min后发现大鼠血浆中槲皮素含量超过100 nM。同时发现,药物作用与性别差异存在一定关系。宋[139]等研究槲皮素在小鼠体内的药代动力学发现,槲皮素亚微乳剂在不同组织中的分布顺序依次是肝>血>肾>脾>肺>心>脑,而槲皮素溶液型注射液在不同组织分布顺序依次是肝>血>肺>肾>心>脾>脑。张[140]等人研究发现槲皮素脂质体纳米粒对肝脏靶向作用良好,且肝脏的槲皮素浓度呈缓慢下降趋势。

第三章槲皮素对ETEC-O139诱导的IPEC-J2细胞损伤的作用研究...........45
3.1材料........................45
3.2方法...............................46
3.3结果...............................50
3.4讨论................................54
3.5小结..............................56
结论....................57
3.4讨论
肠道是消化吸收的主要场所,又是机体的一道防线,对机体有重要的保护作用。炎症是机体对有害刺激的一种自我保护性反应,当有病原微生物、细胞损伤及其他有害刺激物出现,就会引起机体炎症反应[196]。ETEC通过黏附和释放毒素作用,造成IPEC-J2细胞的炎性损伤,导致TNF-α、IL-1和IL-6等炎性细胞因子分泌[197]。有研究表明,肠上皮细胞通透性增加是由于TNF-α造成的[198]。大量研究表明,槲皮素具有抗炎作用,可以显著降低LPS诱导的胶质细胞的TNF-α和IL-1α的mRNA表达[142]。
之前研究确定了槲皮素与ETEC-O139的作用浓度,但在进行细胞毒性试验分析,发现40μg/mL的槲皮素影响细胞生长,因此选择了5μg/mL、10μg/mL和20μg/mL的药物浓度进行研究,因为药物在40μg/mL的范围内并没有显著抑制细菌生长,所以选择的新药物浓度也是属于低于MIC的药物浓度。根据槲皮素在体内代谢动力学,确定了药物作用时间为4 h。菌毛介导的黏附是ETEC发挥致病作用的关键,Maryam[199]等通过体外实验研究发现,乳酸杆菌显著抑制ETEC对HT-29细胞的黏附作用。Duan[32]等通过采用多表位抗原融合技术,针对ETEC菌毛相关的疫苗进行研制,发现该疫苗可以发挥抗体定向抑制细菌黏附作用,在预防仔猪腹泻方面有很大的应用前景。我们的研究发现,在黏附试验中,槲皮素可以显著抑制ETEC-O139对IPEC-J2的黏附,说明槲皮素可以发挥抗细菌黏附作用保护IPEC-J2细胞,这一结果与第二章槲皮素抑制ETEC-O139黏附的结果一致。LDH是一种胞内酶,正常时细胞外含量较低,当细胞受损时,胞内的LDH会大量释放,通过收集细胞培养液,判断细胞是否受损,所以通过这种方式,建立了ETEC-O139诱导的IPEC-J2细胞炎性损伤模型。
结论
1.槲皮素在不抑制ETEC-O139生长的条件下,造成ETEC-O139的细胞过程、代谢过程、对刺激反应、生物调节和定植等生物学过程以及细菌趋化、LPS合成、ABC转运体、群体感应和生物膜生成等通路发生变化。
2.槲皮素通过影响群体感应相关基因(LuxS、Pfs、LsrB、LsrK和LsrR)以及生物膜生成相关基因(CsgA、CsgB、FimA、FliC和Rpos)的表达抑制群体感应和生物膜生成。
3.槲皮素具有抗ETEC-O139诱导的IPEC-J2细胞的炎性损伤作用,这种抗炎作用是通过抑制细菌黏附和调节TLR4/NF-κB信号通路实现的。
参考文献(略)
