本文是一篇医学论文,笔者认为MCDs可以促进炎症及正常状态下rBMSCs中成骨分化早期基因(Runx2、Sp7、ALP和COL-1)、成骨相关蛋白(COL-1和DMP1)的表达,增强ALP活性,并促进晚期成骨分化标志钙结节的形成,说明MCDs可以促进炎症及正常状态下rBMSCs的成骨分化,而且作用优于二甲双胍。
第1章 绪论
1.1 牙周组织再生的策略及面临问题
1.1.1 牙周组织再生的策略
牙周炎是发生在牙齿支持组织包括牙龈、牙周膜、牙骨质和牙槽骨的炎症性疾病,是常见的口腔疾病之一[1, 2]。有研究报道牙周炎已经成为全球第六大流行病,并且其患病率正在日益增加[3]。牙周炎的典型临床特征是不可逆的牙槽骨破坏和牙齿松动、脱落[4]。牙周炎不仅影响咀嚼、发音和美观等其他口腔功能,还与全身系统性疾病密切相关,如心血管疾病、糖尿病、肺部疾病、类风湿性关节炎、癌症和阿尔茨海默氏病等[1, 5-8]。牙周炎治疗的最终目标是实现牙周组织的再生,然而传统的治疗方法(口腔洁治术、刮治术、根面平整术和翻瓣术等)虽可有效减轻炎症、控制疾病的进展,但不能获得满意的牙周组织再生[1, 9]。目前临床牙周组织再生的策略主要有再生性手术、生物制剂的应用以及基于干细胞的治疗方法。
再生性手术包括植骨术和引导组织再生术(Guided Tissue Regeneration, GTR),也可两者联合应用。植骨术是指利用自体骨或骨的替代品等移植材料植入牙槽骨缺损部位,恢复牙槽骨生理外形的手术方法。植骨材料可包含自体骨、异体骨以及人工合成骨等。自体骨是目前临床骨移植的金标准[10]。牙周组织再生的自体骨来源主要有上颌颧牙槽嵴、鼻棘、下颌支、颏部、磨牙后区骨以及髂骨等[11]。异体骨通常主要为新鲜冷冻骨、冻干骨和脱钙冻干骨[12]。有研究报道在上颌窦提升中应用新鲜冷冻骨,表现出良好的生物相容性,并在骨增量效果上可达到自体骨移植水平[13];使用冻干骨进行牙槽嵴骨增量,临床效果及组织学分析均表明冻干骨有效形成矿化的板层骨[14];脱钙冻干骨可以暴露释放骨形态蛋白,缓释骨生长因子,诱导间充质干细胞成骨分化,促进骨再生[15]。
1.2 碳点的生物医学应用及前景
1.2.1 碳点的生物医学应用
碳点(carbon dots, CDs)是一种衍生自碳源的荧光纳米材料[48],尺寸通常小于10 nm,具有优异的性能,包括荧光特性、水溶性、生物相容性、体积小和便于修饰等,可以与其他纳米粒子进行多功能共轭,而且碳点的合成原料丰富、廉价、易得,合成方法简单,适合大规模生产[48-51]。因此,碳点在生物医学领域得到了广泛的关注[50-55]。目前碳点的生物医学应用主要集中在生物成像、生物传感、药物递送、及抗菌等方面[56, 57]。
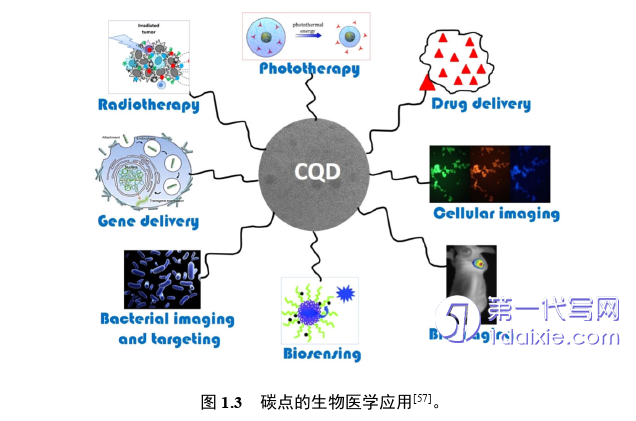
碳点出色的光学性质使其在生物成像领域得到广泛应用。碳点作为生物成像的纳米探针,通过控制碳化条件(例如温度,脱水剂和溶剂等),可以有效地调节碳点的粒径,碳点的表面功能化也可以增强其光稳定性。Sun等发现PEG1500/PPEI-EI钝化的碳点具有很强的光致发光性,并率先将其应用于细胞成像[58]。
第2章 二甲双胍碳点(MCDs)的合成与表征
2.1 实验材料及仪器
实验材料与仪器见表2.1
碳点(CDs)作为一类新型的荧光纳米材料,由于具有出色的生物相容性、优异的光学性质、高量子产和丰富的低成本来源,已经在生物成像、生物传感、药物/基因递送、抗癌、抗菌、抗病毒、抗氧化等生物医学领域有着很好的应用前景[48-57]。近年来,碳点在骨组织再生领域中也得到广泛关注[75,76]。
在本章中,采用一步水热法将二甲双胍和柠檬酸合成二甲双胍碳点(MCDs)。通过透射电镜和高分辨透射电镜观察MCDs的形态结构,使用X射线衍射(XRD)仪、傅里叶变换红外(FTIR)仪、荧光光谱仪以及紫外-可见分光光度计对MCDs进行化学性质的表征。此外,还通过CCK-8、流式细胞术和小动物活体成像系统对MCDs的生物相容性进行检测,使用激光共聚焦显微镜观察MCDs能否进入细胞。本部分实验为MCDs的进一步体内外研究奠定基础。
2.2 实验方法
2.2.1 水热法制备MCDs
以盐酸二甲双胍和柠檬酸为前体通过水热法合成MCDs[109]。将1 g盐酸二甲双胍和1 g柠檬酸溶解在去离子水中,然后放入高压反应釜中,200℃下加热4小时。室温冷却后,使用0.22 μm的过滤膜过滤,并用渗析袋(截留分子量3500)进一步纯化MCDs。在去离子水中渗析72小时后,将纯化的MCDs水溶液冻干并重新溶解在PBS中,待后续实验使用。MCDs制备过程中盐酸二甲双胍与柠檬酸的投入质量比为1:1,因此,在后续实验中二甲双胍药物的用量为MCDs的一半。
2.2.2 MCDs的化学性质表征
使用Hitachi H-800透射电镜(TEM)和JEOL JEM-2100F高分辨率透射电镜在200 kV的加速电压下检测MCDs的尺寸。使用Siemens D5005 X射线衍射仪检测MCDs的X射线衍射(X-ray powder diffraction, XRD)图谱。使用Nicolet AVATAR 360傅里叶变换红外(FTIR)仪检测柠檬酸、二甲双胍和MCDs的红外光谱。通过Shimadzu RF-5301 PC荧光光谱仪检测MCDs的光致发光谱(PL)。通过Shimadzu 3100紫外-可见分光光度计检测MCDs的紫外可见(UV-vis)吸收光谱。
2.2.3 CCK-8检测细胞毒性
将rBMSCs以3×103细胞/孔的密度接种到96孔板中,设置空白对照组、MCDs组和二甲双胍组。24小时细胞贴壁后,换液使MCDs组中MCDs浓度分别为0.01、0.02、0.05、0.1、0.2、0.5、1和2 mg/mL,二甲双胍组中二甲双胍药物的浓度分别为0.01、0.02、0.05、0.1、0.2、0.5、1和2 mg/mL。继续孵育24小时后,每孔中加入10 μL的CCK-8溶液,孵育2小时。酶标仪读取波长为450 nm的吸光度(A)值。细胞存活率=实验组A值/空白对照组A值×100%。
第3章 MCDs体外促炎症及正常状态下rBMSCs成骨分化 .......... 27
3.1 实验材料及仪器 ................................... 27
3.2 实验方法 ....................................... 28
第4章 MCDs激活ERK/AMPK通路的研究 .................................... 41
4.1 实验材料及仪器 ....................................... 41
4.2 实验方法 ..................................... 42
第5章 MCDs体内促进牙周骨再生的研究 ....................................... 55
5.1 实验材料及仪器 ............................................ 55
5.2 实验方法 ........................................ 56
第5章 MCDs体内促进牙周骨再生的研究
5.1 实验材料及仪器
牙周治疗的最终目标是实现牙周组织的再生,其中牙槽骨的再生至关重要。在前面的实验中,已经证实了MCDs能挽救炎症状态下rBMSCs的成骨分化,接下来需要评估MCDs对体内牙周骨再生的影响。因此,在本章中,采用丝线结扎的方法建立大鼠牙周炎模型,通过micro-CT扫描分析MCDs对牙周炎大鼠牙槽骨吸收的影响,并分析骨及骨小梁相关参数,采用HE染色评估牙槽骨质量。此外还通过HE染色检测了MCDs对大鼠重要器官细胞形态的影响,评价MCDs的体内安全性。本部分实验为MCDs用于牙周炎的临床治疗奠定理论基础。
实验材料与仪器见表5.1
第6章 结论
本研究中,我们以二甲双胍和柠檬酸为原料,通过水热法成功合成了二甲双胍碳点(MCDs)。首先对 MCDs进行化学性质表征,包括MCDs的尺寸、X射线衍射图谱、红外光谱、荧光光谱、紫外-可见吸收光谱等;并开展生物相容性检测,包括MCDs对细胞存活率、细胞周期和凋亡的影响,以及MCDs的体内代谢情况。接下来,检测了MCDs对炎症及正常状态下大鼠骨髓间充质干细胞(rBMSCs)成骨分化的影响,包括rBMSCs中成骨分化早期基因、成骨相关蛋白、ALP活性、钙结节的形成。而且,进一步探讨了MCDs促进炎症及正常状态下rBMSCs成骨分化可能的机制,包括检测ERK和AMPK信号通路的激活、ERK和AMPK信号通路的关系、阻断ERK/AMPK信号通路对MCDs诱导的成骨分化的影响。最后,评价了MCDs对体内牙周炎大鼠牙槽骨再生的影响,包括micro-CT观察牙槽骨高度变化、骨及骨小梁相关参数分析、组织学分析骨再生质量以及体内安全性。
研究结论如下:
(1) MCDs具有纳米尺寸结构,平均直径为3.76 nm;含有丰富的羟基、氨基和羧基基团;具有激发依赖的特征,紫外光照射下呈现蓝色的荧光。MCDs对rBMSCs的细胞存活率、细胞周期和凋亡没有明显的影响,而且可以通过肝脏和肾脏进行代谢,说明MCDs具有良好的生物相容性。此外,MCDs可以进入细胞发挥作用。
(2) MCDs可以促进炎症及正常状态下rBMSCs中成骨分化早期基因(Runx2、Sp7、ALP和COL-1)、成骨相关蛋白(COL-1和DMP1)的表达,增强ALP活性,并促进晚期成骨分化标志钙结节的形成,说明MCDs可以促进炎症及正常状态下rBMSCs的成骨分化,而且作用优于二甲双胍。
(3) MCDs在炎症和正常状态下均可激活ERK和AMPK信号通路。而且,在MCDs诱导的成骨分化过程中,AMPK信号位于ERK信号通路的下游,即MCDs可以激活炎症及正常状态下rBMSCs中ERK/AMPK信号通路。阻断ERK/AMPK信号通路后,MCDs诱导的rBMSCs成骨分化受到抑制,说明MCDs可以通过激活ERK/AMPK信号通路促进炎症及正常状态下rBMSCs的成骨分化。
参考文献(略)
