本文是一篇医学论文,本研究有一定的局限性,用于建立模型的肿瘤块来源于肿瘤细胞系。除肿瘤细胞外,其几乎不包含亲代肿瘤的其他成分。肿瘤发生的确切时间并不清楚,由于观察时间不足,尚未看到多器官转移。仅 5 只小鼠接受小动物 PET/CT 扫描,仅只做了一次扫描,未能持续性的观测肿瘤动态变化,未发现远处转移。
第 1 章 引言
1.1 肺癌的流行病学和治疗模式
2020 年全球癌症统计报告显示,全球估计有 221 万肺癌新发病例(占癌症新发病例总数的 11.4%)和 179 万肺癌死亡病例(占癌症死亡总人数的 18%)。相较于2018 年,肺癌发病人数和死亡人数仍在上升。肺癌的高发病率和死亡率,使得它仍然是癌症相关死亡的首要原因[1]。肺癌的治疗手段多种多样,需要根据不同的病理诊断和分期制定最佳的治疗方案,早期患者在没有手术禁忌症的情况下可以实现肿瘤的完整切除且预后良好;但是中晚期患者在就诊时肿瘤往往已经广泛进展甚至发生远处转移,导致没有手术指征或者手术效果不佳,患者被迫接受传统的放疗或化疗,治疗效果不尽人意[2,3]。新兴技术的出现和分子药物的研发成功,使得肺癌的治疗有了很大的突破,特别是靶向治疗和免疫治疗的出现。但由于靶向治疗和免疫治疗只能使部分患者获益,且大多数病例在治疗一段时间后,肿瘤容易突变耐药而出现复发或转移。如果得不到早期干预的话,患者的 5 年总生存率仍然很低[4,5]。所以要想改善肺癌患者的预后,不仅要从治疗方案上寻求突破,还要对肿瘤发生、发展,肿瘤耐药和肿瘤转移等机制有新的认知[6]。然而,肿瘤耐药和转移的机制十分复杂且未被充分阐明,目前急需对这一机制进行更深层次探索,以期找到新的治疗模式来改善患者的预后。
1.2 肺癌小鼠模型
肺癌小鼠模型是研究肺癌的临床前模型,其所增殖出的肿瘤不仅能够在形态学、组织病理学和分子特征上以与人类原发肿瘤相似,而且能模拟人体肿瘤发生发展的生物学模式[7]。因此,肺癌小鼠模型可以作为一个非常有价值的工具,不仅可以理解肺肿瘤的基本生物学,而且可以开发和验证新的肿瘤干预策略,以及识别早期诊断的标志物[8]。肺癌模型的重要价值吸引了无数的研究者,他们不断地创新和改进建模方法,目前已经有许多适用于癌症研究的小鼠模型被报道出来,这些模型可广泛地分为致癌物诱导小鼠模型、异种移植瘤小鼠模型、同基因小鼠模型、和基因工程小鼠模型[9]。致癌物质诱导模型的优点是可以模拟肺癌发生发展过程中的自然事件,但是其对致癌物的异质性反应、极低的自然发生率和较长的成瘤周期,迫使人们不得不放弃它[10]。最近,通过产生能够携带条件致癌基因和肿瘤抑制基因的小鼠品系使得基因工程小鼠的应用得到了显著的突破,这些突变的基因能够诱导体细胞在局部发生突变形成恶性肿瘤,从而非常接近于模仿人类肺癌的散发特征。但是这类模型在实验中尚未得到广泛的应用,原因在于基因工程小鼠在模型的开发和验证方面是耗时、费力的,研究成本非常大,对研究人员来说是一个巨大的负担[11]。目前为止,人类肿瘤异种移植模型是肿瘤机制研究和抗癌药物研发这一领域内应用最多且最广泛的模型。根据肿瘤接种部位的不同,可以将肿瘤移植模型分为两大类:原位移植模型和异位移植模型。原位模型指的是移植瘤接种于肿瘤组织相对应的器官或者组织内;异位模型则是移植于其他的组织或器官,常用的方法主要是皮下移植和肾包膜下移植[12,13]。因为接种过程短,操作简单,建模后容易观测肿瘤的大小,皮下肿瘤异种移植是目前应用最广泛的抗癌药物检测模型。但由于这些模型很少发生转移,不能真正反映肺癌在体内的生物学特性,因此仍存在争议。另一方面,皮下移植位点与原位肿瘤之间的肿瘤微环境和血管生成的差异,使得该方法在体内疗效预测的可靠性方面存在一定的局限性。但是,原位肿瘤模型可以模拟人类的病理生理状况,包括肿瘤的扩张、血管形成和侵袭以及转移。利用原位肺癌模型评价临床前治疗和探讨肿瘤耐药机制更具有代表性[14-16]。
第 2 章 材料和方法
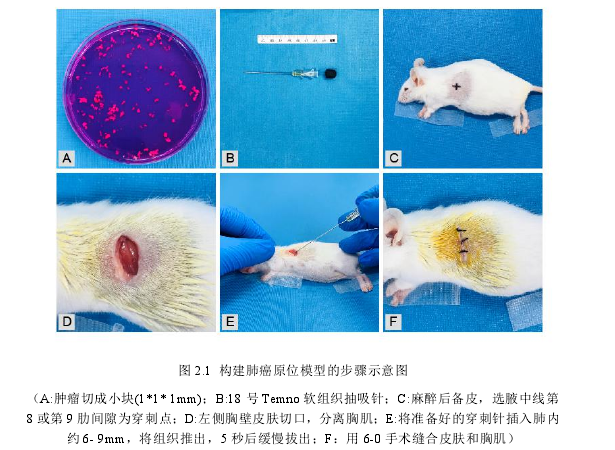
2.1 LLC 细胞培养和皮下移植瘤模型构建
2.1.1 LLC 细胞培养
购于中国典型培养物保藏中心的 Lewis lung cancer 细胞系经解冻复苏后,置于含 10% 胎牛血清及高糖 DMEM 的完全培养基中,置于 37 ℃,5% CO2 饱和温度的培养箱中培养,每 1d 更换培养液 1 次,每 2d 用 0.25% 胰酶消化传代一次,依细胞生长情况进行传代或冻存,照 1 皿传 3 皿的比例,将细胞悬液转到 3 个 10cm 培养皿中,分别加培养基到 10ml/皿,37℃,CO2 培养箱恒温培养。传代细胞汇合率达 90% 时,收集细胞,离心去上清,加入生理盐水吹打,使细胞悬浮于生理盐水中,台盼蓝染色细胞活力测定大于 95% ,并进行细胞计数,调整细胞浓度为 2×10^7/ml 的细胞悬液备用。
2.1.2 皮下移植瘤模型构建
从培养皿中收集培养好的细胞与 Matrigel 胶 1:1 混匀后,接种于 5 只 BALB/C小鼠双侧前肩胛皮下,观察小鼠的存活状态,每日测量体重和肿瘤的大小,以公式 V=a²bπ/2(a 为肿瘤的短径,b 为肿瘤的长径)计算肿瘤体积,当肿瘤生长到体积 1000-1500mm3 时,采用外科手术方法将瘤块纯性分离取出,放置于含生理盐水的培养皿中清洗,消毒和台盼蓝染色鉴定组织活性,为原位模型的构建提供肿瘤组织块。(在整个实验过程中,密切关注小鼠的变化,如果出现如下情况时伦理学处死:1.小鼠出现皮肤溃疡;2.肿瘤任意直径大于 2cm;3.减少食物或水的摄入量;4.弯腰驼背,发声,易怒或毛发无光泽;5.体重下降 20%以上。)
2.2 实验动物和原位模型的构建方法
2.2.1 实验动物
6-8 周龄的雌性 BALB/C 小鼠 55 只,体重约为 25-30g,购于北京维通利华实验动物技术有限公司,根据动物福利机构的指导方针进行护理。饲养在南昌市乐悠生物有限公司实验动物中心无特定病原体( specificpathogen free,SPF) 的饲养间,给予 12h 的昼夜光照循环,小鼠喂食商业鼠粮。所有动物实验均获得南昌乐游生物技术有限公司动物福利伦理委员会批准(批准文号:IACUC IssueNo.RYE2020021801)。标准的动物福利和实验室指南皆遵循美国实验动物科学协会(AALAS)的指南。
2.2.2 原位模型的构建方法
2.2.2.1 皮下移植取瘤和接种前处理
构建好的皮下移植瘤模型,每周使用数显游标卡尺测量肿瘤体积 2 次,肿瘤大小达到取瘤标准后,使用二氧化碳对小鼠施行安乐死,外科手术钝性分离肿瘤块后,放置于含生理盐水的培养皿中清洗、消毒及 0.4%台盼蓝染料染色检测组织活性,活性大于 50%才可进行实验接种。
第 3 章 结果.................................................. 8
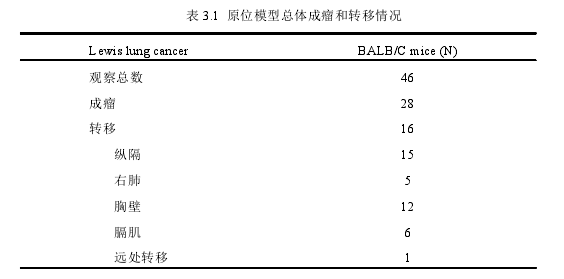
3.1 原位模型成瘤率和转移率...................................... 8
3.2 局部肿瘤的特征............................................ 8
3.3 转移瘤的特征................................. 10
第 4 章 讨论.................................................. 14
第 5 章 结论与展望....................................... 17
5.1 结论.......................................................... 17
5.2 进一步工作的方向........................................ 17
第 4 章 讨论
在本研究中,我们使用 Lewis 肺癌肿瘤碎片经胸壁肺穿刺法建立 BALB/C小鼠同系肺癌原位模型。为了更好地评价肿瘤生物学特征,对所有获取的大体标本进行了拍照,并收集左肺最具代表性的肿瘤病灶进行组织病理学观察。在这些模型中,我们可以看到左肺局部孤立的肿瘤病灶,同侧胸壁组织的浸润,然后是对侧胸壁和右肺转移灶,最后是肾脏远处转移灶。所有这些进展过程都模拟了原发肿瘤发生、发展和自发转移的生物学模式。经病理检查证实,转移瘤的组织病理特征与原发肿瘤一致。此外,我们还应用数字化高分辨率小动物PET/CT 监测活体内的肿瘤进展。小动物 PET 扫描仪采集的数据经过分析重建后展示的图像细节丰富,能清晰显示肿瘤的结构特征及与周围组织的紧密联系。
一个世纪以前,Paget 提出了最初的“种子和土壤”假说来解释肿瘤转移的非随机模式[33]。随着这一假说的验证和发展,人们对肿瘤微环境有了更深的认识。原发肿瘤和转移瘤中癌细胞的生物学异质性是转移癌治疗的主要障碍。此外,特定的器官微环境可以改变转移性肿瘤细胞对系统治疗的疗效反应[34]。许多已开发的药物在临床前研究中反应良好,但临床应用后被证实疗效较差,甚至无疗效,这种低转化率的现象在基础研究领域非常常见,目前的科研有效转化率尚不足 5%。再加上治疗后耐药和肿瘤转移一直以来都是亟待解决的世界性难题,深层次的机制和治疗模式需要更多的基础研究来探索。在一定程度上,转化研究的不足可以通过对建模方法进行创新或改进来弥补[35]。近年来,越来越多的科研工作者认为,在器官特定的部位植入肿瘤细胞对于肿瘤在体内的最佳生长和发展以及对治疗药物的反应至关重要。科研界坚信一个合适和优秀的原位模型是研究肺癌生物学和开发有效的治疗方法的基础[36]。
第 5 章 结论与展望
5.1 结论
本文的研究工作初步探讨了使用组织块穿刺法构建肺癌原位模型的可行性,我们提出的改进方法可靠、可重复性好、微创、简单易掌握,可为建立肺癌患者源性异种移植原位模型提供初步基础。
本研究有一定的局限性,用于建立模型的肿瘤块来源于肿瘤细胞系。除肿瘤细胞外,其几乎不包含亲代肿瘤的其他成分。肿瘤发生的确切时间并不清楚,由于观察时间不足,尚未看到多器官转移。仅 5 只小鼠接受小动物 PET/CT 扫描,仅只做了一次扫描,未能持续性的观测肿瘤动态变化,未发现远处转移。在后续的研究中,我们期待使用临床患者的肿瘤组织来建立肺癌原位模型,人源性异种移植原位模型能够模拟临床患者肿瘤转移的生物学模式,对于个体治疗以及基础应用研究具有重要意义。这些具有完整免疫功能的同基因模型在临床前免疫治疗的研究中具有重要价值。改进小动物 PET/CT 检查的实验设计,或许可以通过小鼠分组并按周次进行动态扫描,并延长观测的时间,使得观测肿瘤动态变化和远处转移更为容易。
参考文献(略)
